生物相似藥單株抗體市場展望:
2025年,生物相似藥單株抗體市場規模為139.9億美元,預計到2035年將超過1,099.9億美元,在預測期間(即2026-2035年)的複合年增長率將超過22.9%。 2026年,生物相似藥單株抗體的產業規模估計為168.7億美元。

在製藥業中,抗體類藥物的製造和生產市場正在迅速發展,成為治療方案。此外,對經濟可行的生物療法的需求以及醫療保健成本的上升,使得生物相似藥成為昂貴傳統藥物的替代品。根據美國國家醫學圖書館(NLM)2024年1月發表的文章,生物相似藥的成本節約效應(尤其是在美國)有所提升,預計2020年至2024年期間生物仿製藥的成本將達到1040億美元,而2015年至2019年期間生物仿製藥的成本將達到1,040億美元,而2015年至2019年期間生物相似藥的成本將達到1,040億美元。因此,生物相似藥的成本效益使其更加普及,從而推動了全球市場的成長。
藥物的成長極大地推動了全球生物相似藥單株抗體市場的擴張。此外,生物相似藥的進入有效降低了美國乃至全球生物製劑的成本。基於此,美國國家醫學圖書館(NLM)於2024年6月發表了一項關於納入生物相似藥後生物製劑支付方定價的分析研究,研究範圍涵蓋57個地區和國家。該研究表明,曲妥珠單抗的平均價格下降了438美元,英夫利西單抗下降了112美元,貝伐單抗下降了110美元。此外,生物相似藥的進入導致每劑價格每年進一步下降,其中阿達木單抗下降49美元,非格司亭下降290美元,英夫利西單抗下降21美元,曲妥珠單抗下降189美元。
關鍵 生物類似單株抗體 市場洞察摘要:
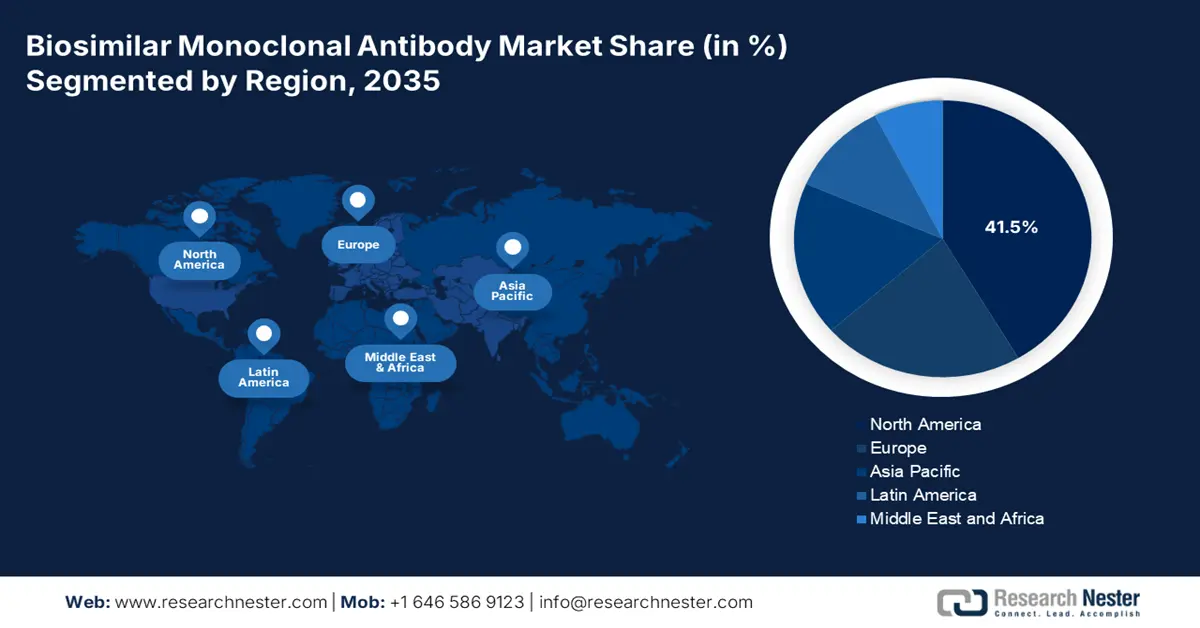
區域亮點:
- 到 2035 年,北美生物相似藥單株抗體市場將佔據 41.50% 的市場份額,這得益於龐大的醫療機構,從而推動市場擴張以滿足患者需求。
細分市場洞察:
- 預計到 2035 年,生物相似藥單株抗體市場中的腫瘤學細分市場將佔據 50.80% 的份額,這得益於單株抗體在癌症治療中的應用,從而增加了患者獲得治療的機會。
- 預計到 2035 年,生物相似藥單株抗體市場中的英夫利西單抗細分市場將佔據 38.60% 的份額,這得益於其在治療自體免疫疾病方面的廣泛應用和較高的臨床緩解率。
主要成長趨勢:
- 患者終止治療
- 採用新型治療方法
主要挑戰:
- 臨床試驗的先決條件
- 嚴格的監理政策
主要參與者:輝瑞公司、安進公司、山德士國際有限公司(諾華公司)、Celltrion公司、三星生物製藥有限公司、Biocon有限公司、邁蘭公司(Viatris)、雷迪博士實驗室有限公司、Coherus BioSciences公司、上海復宏漢霖生物科技有限公司。
全球 生物類似單株抗體 市場 預測與區域展望:
市場規模與成長預測:
- 2025年市場規模: 139.9億美元
- 2026年市場規模: 168.7億美元
- 預計市場規模:到 2035 年將達到 1,099.9 億美元
- 成長預測:複合年增長率22.9%(2026-2035年)
主要區域動態:
- 最大的地區:北美(到 2035 年佔 41.5%)
- 成長最快的地區:亞太地區
- 主要國家:美國、德國、中國、印度、日本
- 新興國家:中國、印度、巴西、墨西哥、韓國
Last updated on : 18 September, 2025
生物相似藥單株抗體市場的成長動力與挑戰:
成長動力
- 病患終止:這有助於製藥機構進行生物相似藥替代品的開發,為生物相似藥單株抗體市場的發展創造豐厚的商機。這促使生物相似藥製造商進入該領域,並引發競爭,從而帶來一系列重要的優勢。此外,美國國家醫學圖書館 (NLM) 在 2021 年發表的一篇文章指出,以透明的方式提供易於理解的信息,並根據患者的需求進行定制,並輔以視聽材料,是讓患者了解生物仿製藥可用性的合適策略,從而對市場提升產生積極影響。
- 採用新型療法:事實證明,這種治療方案比傳統療法更有效,從而擴大了生物相似藥單株抗體市場。例如,根據紀念斯隆凱特琳癌症中心2025年2月的數據,使用單株抗體達雷妥尤單抗治療多發性骨髓瘤可使病情進展或死亡風險降低43%。因此,這種新型療法可確保更多患者接受移植手術—移植手術是一項需要長期住院的複雜手術,從而積極推動全球市場的成長。
挑戰
- 臨床試驗的先決條件:臨床試驗基礎是生物相似藥單株抗體市場擴張的一大障礙。監管機構要求對生物相似藥的開發進行嚴格的臨床試驗,以確認產品的有效性和安全性。這些試驗需要大量的資源配置、時間和資金投入。此外,臨床試驗要求的不斷增加不僅延長了產品開發週期,還帶來了財務負擔,可能會阻礙潛在的製造商進入市場。
- 嚴格的監管政策:嚴格的法規對病人入組構成挑戰,導致入組延遲,這是生物相似藥單株抗體市場發展的限制因素。此外,廣泛的比較研究需求增加了最新生物相似藥的審批時間和成本。儘管生物相似藥是比生物參考藥物更經濟的替代品,但其開發過程仍然過於昂貴。此外,在沒有醫療幹預的情況下以生物相似藥取代生物參考藥物也阻礙了全球市場的成長。
生物相似藥單株抗體市場規模及預測:
| 報告屬性 | 詳細資訊 |
|---|---|
|
基準年 |
2025 |
|
預測期 |
2026-2035 |
|
複合年增長率 |
22.9% |
|
基準年市場規模(2025年) |
139.9億美元 |
|
預測年度市場規模(2035年) |
1099.9億美元 |
|
區域範圍 |
|
生物相似藥單株抗體市場區隔:
適應症
在生物相似藥單株抗體市場中,腫瘤學領域預計到2035年底將佔超過50.8%的收入份額。單株抗體在癌症治療的應用是該領域成長的主要原因。根據世界衛生組織2025年2月的報告,癌症在2020年導致1,000萬人死亡,而肝炎和人類乳突病毒(HPV)等癌症相關感染約佔低收入和中低收入國家癌症病例的30%。然而,正如2022年12月NLM文章所述,使用生物相似藥來控制癌症發生率,使能夠獲得癌症治療和藥物的患者數量增加了44%。
類型
預計到2035年,英夫利西單抗將佔據生物相似藥單株抗體市場38.6%以上的份額。英夫利西單抗是一種廣泛用於治療多種自體免疫疾病的單株抗體,使其成為整個市場的重要組成部分。根據Sage期刊2021年9月發表的臨床研究,發炎性腸道疾病(IBD)患者接受英夫利西單抗再治療後,合併臨床緩解率為85%。此外,87%的克隆氏症患者重新接受英夫利西單抗治療,這對該細分市場的成長產生了積極影響。
我們對全球生物相似藥單株抗體市場的深入分析包括以下幾個部分:
適應症 |
|
類型 |
|
最終用戶 |
|

Vishnu Nair
全球業務發展主管根據您的需求自訂本報告 — 與我們的顧問聯繫,獲得個人化的洞察與選項。
生物相似藥單株抗體市場區域分析:
北美市場洞察
預計到2035年,北美生物相似藥單株抗體市場的收入份額將達到41.5%左右。根據美國醫院協會2025年1月的報告,該地區擁有6093個醫療基礎設施,其中包括5,112家社區醫院、207家聯邦政府中心和654家非聯邦精神病院。此外,該地區還擁有1796家農村社區醫院、3316家城市醫院和3525家社區醫院。因此,由於該地區擁有眾多醫療機構,市場擁有充足的擴張機會,能夠更好地服務患者,並幫助他們戰勝疾病。
由於用於治療罕見疾病的生物相似藥的出現,美國生物相似藥單株抗體市場正受到越來越多的關注。根據2020年2月的NLM文章,利妥昔單抗、曲妥珠單抗和貝伐單抗因其有效用途已在美國獲得批准。利妥昔單抗有助於治療非何杰金氏淋巴瘤和慢性淋巴球白血病;曲妥珠單抗適用於治療胃癌和乳癌;貝伐單抗可用於治療卵巢癌、子宮頸癌、腎癌、大腸癌、肺癌和乳癌。此外,美國食品藥物管理局(FDA)於2024年5月批准jubbonti注射液作為與美國上市的Prolia相容的生物相似藥,並批准Wyost注射液作為與美國上市的Xgeva相同的生物相似藥,從而促進了市場擴張。
加拿大生物相似藥單株抗體市場正經歷顯著成長,原因是該國引入了大量生物相似藥,需要製定有效的管理政策和策略。根據加拿大衛生部2025年1月的報告,生物藥品的命名、國際協議、產品專論以及利益相關者的參與是該國生物相似藥全面管理所需的一些指導性文件。所有這些文件都有助於製造商遵循合法途徑生產生物相似藥,從而有效地促進市場成長。
亞太市場洞察
亞太地區的生物相似藥單株抗體市場是成長最快的地區,預計在預測期內將實現豐厚的成長。龐大的人口、不斷增長的醫療支出以及經濟高效的治療方案等因素,正在推動該地區市場的擴張。例如,根據世界銀行集團2024年4月的報告,截至2021財年,該地區基於國內生產毛額的最新醫療支出佔比為6.76%。因此,這使得該地區的患者能夠更經濟地獲得和購買生物相似藥,從而對市場的成長和擴張產生積極影響。
印度生物相似藥單株抗體市場預計將大幅成長,因為區域組織已承擔起透過深入研發推出最新生物相似藥的責任。例如,2023年11月, Enzene Biosciences推出了雷珠單抗(Ranibizumab),這是創新藥物Lucentis的生物相似藥,Lucentis在印度以Accentrix的品牌名稱銷售。雷珠單抗是一種重組藥物,用於治療新生血管性老年黃斑部病變(AMD)。此外,該生物相似藥是Enzene Biosciences的第七款生物相似藥,可顯著降低印度數千名患者的治療成本,從而有效推動市場發展。
由於大量的試驗和擴張以及政策支持,中國單株抗體生物相似藥市場正在蓬勃發展。根據2023年2月的《仿製藥和生物相似藥倡議報告》,這些抗體因其成本低廉且在國內易於獲取,已成為治療自體免疫疾病的關鍵療法。此外,中國擁有大量的生物相似藥,其中貝伐單抗和阿達木單抗是該地區市場常見的熱門藥物,市場供應充足,發展勢頭良好。
中國熱門生物相似藥研發項目
生物相似藥 | 臨床前 | IND | 第一階段 | 第二階段 | 第三階段 | 保密協議 | 已推出 | 全部的 |
艾克美拉 | 1 | 2 | 4 | 7 | ||||
可善挺 | 1 | 1 | ||||||
達札萊克斯 | 1 | 1 | ||||||
愛必妥 | 2 | 2 | 2 | 4 | 10 | |||
赫賽汀 | 2 | 2 | 6 | 1 | 11 | |||
萊姆特拉達 | 1 | 1 | 2 | |||||
美羅華 | 3 | 1 | 6 | 2 | 12 |
資料來源:仿製藥和生物相似藥倡議組織 2023 年 2 月
生物相似藥單株抗體市場參與者:
- 羅氏
- 公司概況
- 商業策略
- 主要產品
- 財務表現
- 關鍵績效指標
- 風險分析
- 近期發展
- 區域影響力
- SWOT分析
- 諾華
- 輝瑞
- 三星 Bioepis
- 安進
- 邁蘭
- 梯瓦製藥工業公司
- 百健
- 賽爾群
- 費森尤斯卡比
- 山德士
- 勃林格殷格翰
- 默克
- 阿姆尼爾製藥公司
- Biocon Biologics有限公司
- 賽爾群
- Enzene 生物科學
生物相似藥單株抗體市場的主導企業正迅速獲得關注,這得益於其臨床表現,這些產品適用於治療全球範圍內影響患者的各種疾病。此外,行政機構在這些生物相似藥的審批中也發揮著至關重要的作用。例如,2024年9月,費森尤斯卡比(Fresenius Kabi)和福米康(Formycon)的生物相似藥Otulfi(ustekinumab-aauz)獲得了美國食品藥物管理局(FDA)的批准。該藥物已被證明可用於治療克羅恩病、潰瘍性結腸炎、中度至重度斑塊狀銀屑病以及活動性銀屑病關節炎,因此該市場在全球擴張的前景樂觀。
以下是一些關鍵人物的名單:
最新動態
- 2025 年 2 月, Celltrion通知歐盟委員會 (EC) 批准生物相似藥——Eydenzelt,一種用於治療多種視網膜疾病的 Eylea 生物相似藥,以及 Stoboclo 和 Osenvelt,參考 Prolia 和 Xgeva 的生物仿製藥,用於參考產品的所有適應症。
- 2024年12月, Biocon Biologics Ltd宣布美國食品藥物管理局 (FDA) 批准YESINTEK,這是參考產品Stelara的生物相似藥。此單株抗體獲準用於治療克隆氏症、潰瘍性結腸炎、斑塊狀乾癬和乾癬關節炎。
- Report ID: 7276
- Published Date: Sep 18, 2025
- Report Format: PDF, PPT
- 探索关键市场趋势和洞察的预览
- 查看样本数据表和细分分析
- 体验我们可视化数据呈现的质量
- 评估我们的报告结构和研究方法
- 一窥竞争格局分析
- 了解区域预测的呈现方式
- 评估公司概况与基准分析的深度
- 预览可执行洞察如何支持您的战略
探索真实数据和分析
常见问题 (FAQ)
生物類似單株抗體 市场报告范围
版权所有 © 2026 Research Nester。保留所有权利。




