Perspectivas del mercado de software de comparación de ensayos clínicos:
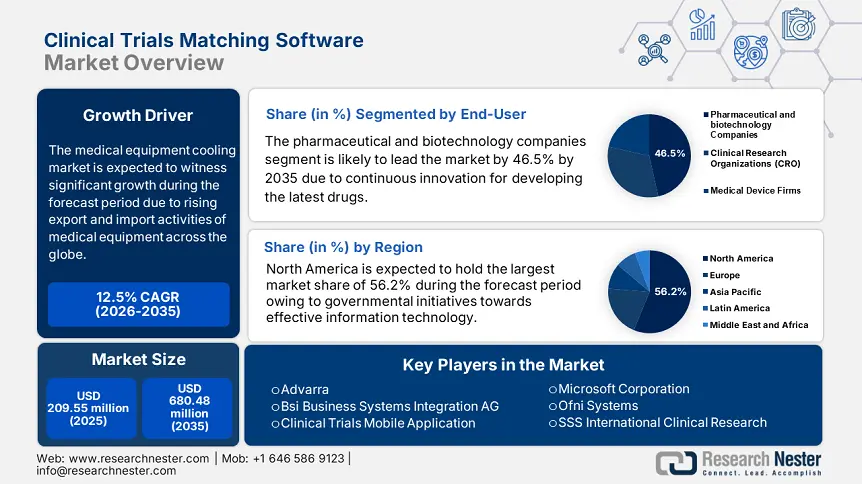
El mercado de software de emparejamiento de ensayos clínicos se valoró en 209,55 millones de dólares en 2025 y se espera que alcance los 680,48 millones de dólares para 2035, con una tasa de crecimiento anual compuesta (TCAC) de alrededor del 12,5 % durante el período de pronóstico, es decir, entre 2026 y 2035. En 2026, el tamaño de la industria del software de emparejamiento de ensayos clínicos se estima en 233,12 millones de dólares.
La implementación de herramientas de software automatizadas en ensayos clínicos garantiza un método eficiente para la identificación rápida de pacientes potencialmente elegibles en la investigación clínica, lo que impulsa considerablemente el auge del mercado de software de emparejamiento de ensayos clínicos. Según un artículo publicado por la NLM en febrero de 2023, existen diferentes fases de un ensayo clínico: la Fase 0 (explorativa), las Fases Ia, Ib y Ic (ensayos no terapéuticos), las Fases II, IIa y IIb (ensayos exploratorios), la Fase III (ensayos confirmatorios terapéuticos) y la Fase IV (estudios post-aprobación). Por lo tanto, la combinación de todas estas fases y la inclusión de herramientas de software innovadoras son lo suficientemente efectivas como para impulsar la expansión del mercado.
El mercado de software de emparejamiento de ensayos clínicos está experimentando un auge gracias al uso de tecnologías y sistemas de procesamiento para evaluar la probabilidad del estudio, simplificar el reclutamiento y el mantenimiento de participantes, permitir el acceso a diversas poblaciones, racionalizar la recopilación de datos y facilitar su gestión. En consecuencia, la implementación de computadoras y conjuntos de herramientas en ensayos clínicos es cada vez más común, lo que impulsa su creciente demanda. Según el informe de la OEC de 2023, el valor del comercio mundial de computadoras fue de 323 000 millones de dólares, siendo China el principal exportador con 158 000 millones de dólares y Estados Unidos el principal importador con 93 200 millones de dólares.
Además, el uso de conjuntos de herramientas en ensayos clínicos resulta útil para la gestión eficaz de las operaciones, los datos y la comunicación del estudio a lo largo de todo el ciclo de vida del ensayo, lo que facilita el desarrollo del mercado de software de compatibilidad de ensayos clínicos. Además, estos ayudan a facilitar los cambios en la práctica y pueden incluir estrategias para la implementación de directrices, la fundamentación de políticas y el suministro de materiales de auditoría de calidad. Según el informe de la OEC de 2023, el comercio internacional de conjuntos de herramientas está valorado en 1290 millones de dólares estadounidenses, con China como principal exportador con 606 millones de dólares estadounidenses y Alemania como principal importador con 114 millones de dólares estadounidenses, lo que impacta positivamente en el crecimiento del mercado.
Comparación de Exportación/Importación de Computadoras y Conjuntos de Herramientas
Países | Computadoras | Conjuntos de herramientas | ||
Exportar | Importar | Exportar | Importar | |
México | 29.5 mil millones de dólares | - | - | - |
Taipéi | USD 27.100 millones | - | USD 158,0 millones | - |
Vietnam | USD 15.900 millones | - | - | - |
Estados Unidos | 15.300 millones de dólares | 93.200 millones de dólares | 59.600 millones de dólares millones | USD 82,4 millones |
Alemania | - | USD 20.400 millones | USD 147,0 millones | USD 114,0 millones |
Hong Kong | - | 15.500 millones de dólares | - | - |
Países Bajos | - | USD 14.300 millones | USD 29,3 millones | USD 68,4 millones |
Reino Unido | - | 13.000 millones de dólares | - | - |
Rusia | - | - | - | USD 114,0 millones |
Francia | - | - | - | USD 93,7 millones |
Fuente: OEC 2023
Clave Software de comparación de ensayos clínicos Resumen de Perspectivas del Mercado:
Aspectos destacados regionales:
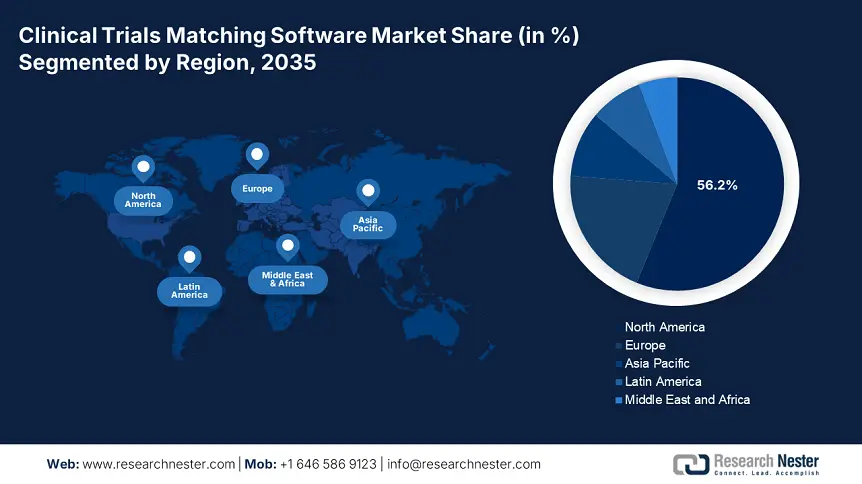
- América del Norte posee una participación del 56,20 % en el mercado de software de emparejamiento de ensayos clínicos, impulsada por la aceptación de los sistemas de emparejamiento de ensayos clínicos, las estrategias gubernamentales y las iniciativas de los NIH, lo que garantiza un sólido crecimiento para 2035.
- Se espera que el mercado de software de emparejamiento de ensayos clínicos de Asia Pacífico experimente el mayor crecimiento para 2035, debido a la disponibilidad de un gran número de pacientes y al aumento de proyectos de TI para el sector sanitario.
Perspectivas del segmento:
- Se prevé que el segmento de empresas farmacéuticas y biotecnológicas alcance más del 46,5 % de la cuota de mercado para 2035, impulsado por el gran número de ensayos clínicos necesarios para el lanzamiento del producto.
- Se proyecta un crecimiento sustancial del segmento de software entre 2026 y 2035, debido al mayor uso y la adopción de ensayos clínicos, la implementación de investigación y desarrollo, y las generosas contribuciones de las organizaciones médicas.
Tendencias Clave de Crecimiento:
- Aumento de la actividad de ensayos clínicos
- Digitalización en la investigación
Principales desafíos:
- Software costoso
- Capacitación y adaptación insuficientes
- Actores clave: Advarra, Antidote Technologies, Inc., IBM Clinical Development, aplicación móvil de ensayos clínicos.
Global Software de comparación de ensayos clínicos Mercado Pronóstico y perspectiva regional:
Tamaño del mercado y proyecciones de crecimiento:
- Tamaño del mercado para 2025: USD 209,55 millones
- Tamaño del mercado para 2026: USD 233,12 millones
- Tamaño del mercado proyectado: USD 680,48 millones para 2035
- Pronósticos de crecimiento: 12,5 % CAGR (2026-2035)
Dinámica regional clave:
- Región más grande: América del Norte (participación del 56,2 % en 2035)
- Región de más rápido crecimiento: Asia Pacífico
- Países dominantes: Estados Unidos, Alemania, Japón, Reino Unido, Francia
- Países emergentes: China, India, Brasil, Rusia, México
Last updated on : 25 August, 2025
Impulsores y desafíos del crecimiento del mercado de software de comparación de ensayos clínicos:
Impulsores del Crecimiento
- Aumento de la actividad de ensayos clínicos: Se prevé que el mercado de software de comparación de ensayos clínicos experimente un impulso gracias a la mejora de estos a nivel internacional. Según el informe de la OMS de diciembre de 2024, Estados Unidos experimentará un aumento de 186.497 ensayos, seguido de 135.747 en China, 74.031 en India, 65.167 en Japón, 54.902 en Alemania y muchos más. Esto se debe a la mayor penetración de tecnologías sanitarias avanzadas, junto con la creciente demanda de medicamentos innovadores con una eficacia superior, lo que impulsa rápidamente el desarrollo y la evolución del mercado.
- Digitalización en la investigación: La incorporación de tecnología sofisticada, como la captura electrónica de datos (EDC) y los sistemas de gestión de ensayos clínicos, está aumentando la demanda del mercado de software de comparación de ensayos clínicos a nivel mundial. Según un artículo publicado en Mayo Clinic Proceedings en octubre de 2023, el 94 % de los hospitales en EE. UU. utilizaban con facilidad un historial clínico electrónico (HCE) para brindar atención clínica, lo que representaba el 45 % de la población regional total que incluía un historial médico en el HCE. El HCE se concibió principalmente como una herramienta para la atención centrada en el paciente, pero los investigadores clínicos han utilizado su adopción casi universal en diversos aspectos de sus estudios.
Desafíos
- Software costoso: El alto precio de los sistemas de software de emparejamiento está obstaculizando el crecimiento del mercado de software de emparejamiento de ensayos clínicos. Algunos aspectos del software, como las tarifas de inicio, por usuario, compromiso contractual, por estudio, mantenimiento, capacitación, soporte e integración de sistemas, aumentan el costo total requerido para la implementación de soluciones de software de emparejamiento de ensayos clínicos. Además, los costos de personalización y configuración se cobran a las organizaciones según los requisitos específicos de la organización y la investigación.
- Capacitación y adaptación insuficientes: Los profesionales de la salud pueden carecer de la capacitación esencial para utilizar eficazmente las herramientas avanzadas de emparejamiento de ensayos clínicos, lo que limita sus probables beneficios. Además, los ensayos complejos suelen incluir múltiples variables y criterios de elegibilidad estrictos, lo que dificulta que los profesionales proporcionen soluciones de software para emparejar a los pacientes de forma precisa y eficiente. Esto crea una brecha en la ejecución general de los ensayos que conduce a resultados incompletos, lo que limita el mercado global de software de emparejamiento de ensayos clínicos.
Tamaño y pronóstico del mercado de software de comparación de ensayos clínicos:
| Atributo del informe | Detalles |
|---|---|
|
Año base |
2025 |
|
Período de pronóstico |
2026-2035 |
|
Tasa de crecimiento anual compuesta (TCAC) |
12,5% |
|
Tamaño del mercado del año base (2025) |
USD 209,55 millones |
|
Tamaño del mercado según el pronóstico anual (2035) |
USD 680,48 millones |
|
Alcance regional |
|
Segmentación del mercado de software de comparación de ensayos clínicos:
Usuario final (Empresas farmacéuticas y biotecnológicas, Organizaciones de Investigación Clínica (CRO), Empresas de Dispositivos Médicos)
Se espera que el segmento de empresas farmacéuticas y biotecnológicas alcance una cuota de mercado de software de ensayos clínicos superior al 46,5 % para 2035. Esta evolución se atribuye al gran número de ensayos clínicos necesarios para el lanzamiento del producto. Por ejemplo, según el informe de la FDA estadounidense de abril de 2024, el CDER lanzó con éxito un centro para la innovación en ensayos clínicos (C3T1) para impulsar iniciativas innovadoras y funcionar como un punto central de coordinación, intercambio de conocimientos y comunicación con actores internos y externos. Por lo tanto, este desarrollo, en colaboración con la FDA, supone una importante contribución al impulso del mercado a nivel mundial.
Componentes (Software, Servicios)
Se espera que el segmento de software influya considerablemente en el mercado de software de comparación de ensayos clínicos durante el período de pronóstico. Este crecimiento se atribuye al mayor uso y adopción de ensayos farmacológicos, la implementación de investigación y desarrollo, y las generosas contribuciones de las organizaciones médicas para promover y llevar a cabo ensayos farmacológicos complejos. Por ejemplo, como se indica en el artículo de febrero de 2025 publicado por Drug Discovery Today, la probabilidad promedio de primera aprobación representa el 14,3 % en las principales compañías farmacéuticas basadas en la investigación, con un rango amplio de entre el 8 % y el 23 %. Por lo tanto, esto garantiza una tasa de éxito general del desarrollo clínico que oscila entre el 7 % y el 25 %.
Nuestro análisis exhaustivo del mercado global de software de emparejamiento de ensayos clínicos incluye los siguientes segmentos:
|
Usuario final |
|
|
Componentes |
|
|
Modo de implementación |
|

Vishnu Nair
Jefe de Desarrollo Comercial GlobalPersonalice este informe según sus necesidades: conéctese con nuestro consultor para obtener información y opciones personalizadas.
Análisis regional del mercado de software de comparación de ensayos clínicos:
Análisis del Mercado de Norteamérica
Para finales de 2035, se prevé que el mercado norteamericano de software de emparejamiento de ensayos clínicos domine alrededor del 56,2% de los ingresos. Factores como la aceptación de los sistemas de emparejamiento de ensayos clínicos por parte de organizaciones biotecnológicas y farmacéuticas, las estrategias gubernamentales y la adopción de software de emparejamiento de pacientes, así como de software de emparejamiento de ensayos clínicos, están impulsando considerablemente la expansión del mercado en la región. Por ejemplo, en septiembre de 2024, los Institutos Nacionales de la Salud (NIH) lanzaron una serie de iniciativas, entre ellas los Estudios Experimentales Básicos con Humanos (BESH), la revisión, financiación y prácticas basadas en ensayos clínicos, formularios de información humana, plantillas de protocolo, y formación y recursos adecuados para el desarrollo del mercado.
El mercado estadounidense de software de emparejamiento de ensayos clínicos ha ido ganando terreno gracias a la promulgación de directrices adecuadas por parte de los organismos administrativos. Por ejemplo, la FDA de EE. UU., en su informe de septiembre de 2022, propuso que la sección 201(h) de la Ley Federal de Alimentos, Medicamentos y Cosméticos (FD&C Act) incluyera software diseñado para brindar apoyo en la toma de decisiones para el diagnóstico, tratamiento, prevención, cura o mitigación de enfermedades u otras afecciones. Además, según la sección 520(o)(1)(E), los sistemas de imágenes médicas como rayos X, tomografía computarizada (TC), resonancia magnética (RM) y ultrasonido son adecuados para fines médicos. Por lo tanto, la implementación de las directrices garantiza un impacto positivo en el crecimiento del mercado. El mercado de software de emparejamiento de ensayos clínicos en Canadá está experimentando un crecimiento significativo gracias a las inversiones gubernamentales y las contribuciones de los investigadores. Según el informe de los Institutos Canadienses de Investigación en Salud de julio de 2023, el Gobierno de Canadá invirtió 250 millones de dólares estadounidenses para financiar ensayos clínicos, una iniciativa para fortalecer la Estrategia de Biofabricación y Ciencias de la Vida de Canadá. Además, investigadores del Instituto de Investigación del Cáncer de Ontario desarrollaron en febrero de 2024 PMATCH, un sistema automatizado para vincular ensayos clínicos de medicina de precisión con pacientes con cáncer adecuados. Por lo tanto, con todos estos desarrollos y fondos, el mercado tiene mayor exposición para impulsar y expandirse.
Estadísticas del Mercado de Asia-Pacífico
El mercado de software de vinculación de ensayos clínicos en Asia-Pacífico es la región de más rápido crecimiento y se prevé un crecimiento lucrativo durante el período previsto gracias a la disponibilidad de un gran número de pacientes. Además, diversas organizaciones buscan ubicar sus actividades de investigación y desarrollo en la región para impulsar la expansión del mercado. Esto se debe al aumento en el número de proyectos de TI para la atención médica, el desarrollo de la economía y la modernización completa de las infraestructuras sanitarias, especialmente en países en desarrollo como India y China, lo que denota el auge del mercado.
Se espera un crecimiento sustancial del mercado de software de vinculación de ensayos clínicos en India, ya que estos ensayos se implementan fácilmente para la evaluación de terapias para pacientes con cáncer. Por ejemplo, según un artículo publicado por la NLM en febrero de 2024, NexCAR19 es la primera terapia con células CAR-T del país aprobada por la FDA estadounidense, basada en dos ensayos clínicos con 64 pacientes con leucemia avanzada. Según los ensayos, el 67 % de los pacientes experimentó una disminución significativa de la incidencia de cáncer (respuesta objetiva), y aproximadamente la mitad de los pacientes desaparecieron por completo (respuesta completa). Por lo tanto, con el desarrollo de terapias innovadoras, se espera que el mercado prospere en el país. El mercado de software de emparejamiento de ensayos clínicos en China está ganando terreno gracias a la innovación y los avances para evaluar el aspecto clínico de los pacientes con enfermedades raras. Según el artículo de la NLM de febrero de 2024, se realizó un estudio retrospectivo con 1053 pacientes hospitalizados con diagnóstico de carcinoma hepatocelular para evaluar la inteligencia artificial en el sistema de emparejamiento de ensayos clínicos (CTMS). El estudio reveló una confiabilidad interevaluadora aceptable que osciló entre 0,65 y 0,88 con una tasa de precisión entre el 92,9% y el 98,0%. Además, la sensibilidad osciló entre el 51,9% y el 83,5%, la especificidad entre el 99,0% y el 99,1%, el valor predictivo positivo entre el 75,7% y el 85,1% y el valor predictivo negativo entre el 97,4% y el 98,9%.
Actores clave del mercado de software de comparación de ensayos clínicos:
-
Las empresas que dominan el mercado de software de comparación de ensayos clínicos están ganando visibilidad rápidamente debido a la creciente demanda de análisis de datos en tiempo real por parte de los investigadores. Además, los avances en inteligencia artificial (IA) están transformando pasos clave del diseño de ensayos clínicos para obtener tasas de éxito acumuladas. En base a esto, en enero de 2024, Accenture anunció una inversión estratégica, a través de Accenture Ventures, en QuantHealth para permitir que las organizaciones farmacéuticas y biotecnológicas desarrollen tratamientos para pacientes de forma rápida y rentable. Esto demuestra un enfoque optimista para que el mercado se expanda de forma eficaz y eficiente.
- Advarra
- Descripción general de la empresa
- Estrategia empresarial
- Ofertas clave de productos
- Rendimiento financiero
- Indicadores clave de rendimiento
- Análisis de riesgos
- Desarrollo reciente
- Presencia regional
- Análisis FODA
- Antidote Technologies, Inc.
- Accenture
- IBM Clinical Development
- Aplicación móvil de ensayos clínicos
- Investigación Clínica Internacional SSS
- Aris Global
- Clario
- Bsi Business Systems Integration AG
- Microsoft Corporation
- Ofni Systems
- Oracle
- IQVIA
- Syneos Health
Además, con tecnología de IA exclusiva entrenada con un conjunto masivo de datos de 350 millones de pacientes, enormes gráficos basados en conocimiento biomédico y datos de ensayos clínicos, la plataforma de simulación de QuantHealth puede predecir los resultados de los ensayos con una precisión considerable. Esto también puede evaluar variaciones del protocolo y determinar el diseño de ensayo ideal para el éxito, ayudando a los equipos de investigación y desarrollo (I+D) a predecir con mayor precisión y rapidez los resultados de los ensayos clínicos y a decidir si un ensayo debe progresar, optimizar las cohortes, si los medicamentos pueden reutilizarse y otros factores cruciales. Todos estos factores contribuyen al auge del mercado a nivel global.
A continuación, se presenta la lista de algunos actores clave:
Desarrollos Recientes
- En enero de 2025, Syneos Health firmó un acuerdo con ACTIVATO para ampliar sus competencias en ensayos clínicos en una amplia gama de áreas terapéuticas en Japón. El objetivo es acelerar el impacto de su desarrollo clínico en este mercado en constante crecimiento y evolución.
- En junio de 2024, IQVIA notificó el lanzamiento de One Home for Sites, la plataforma tecnológica de vanguardia que funciona como un inicio de sesión único y un panel de control único para los sistemas y tareas clave que un centro de investigación clínica necesita para ejecutar todos los ensayos clínicos que lleva a cabo.
- En mayo de 2024, Oracle realizó avances en su sistema global de aleatorización y gestión de suministro de ensayos (RTSM) Clinical One, mejorando la regionalización, el acceso y la asistencia a los usuarios con las normativas específicas de cada país, además de la fiabilidad y la transparencia de los ensayos desde su inicio hasta su cierre.
- Report ID: 7333
- Published Date: Aug 25, 2025
- Report Format: PDF, PPT
- Explore una vista previa de las principales tendencias e ideas del mercado
- Revise tablas de datos de muestra y desgloses por segmento
- Experimente la calidad de nuestras representaciones visuales de datos
- Evalúe nuestra estructura de informe y metodología de investigación
- Obtenga una vista de la análisis del panorama competitivo
- Comprenda cómo se presentan las previsiones regionales
- Evalúe la profundidad del perfilado de empresas y análisis comparativo
- Vea cómo los insights accionables pueden respaldar su estrategia
Explore datos y análisis reales
Preguntas frecuentes (FAQ)
Software de comparación de ensayos clínicos Alcance del informe de mercado
La muestra gratuita incluye el tamaño del mercado actual e histórico, tendencias de crecimiento, gráficos y tablas regionales, perfiles de empresas, previsiones por segmento y más.
Conéctate con nuestro experto
Derechos de autor © 2026 Research Nester. Todos los derechos reservados.




