罕见病治疗市场展望:
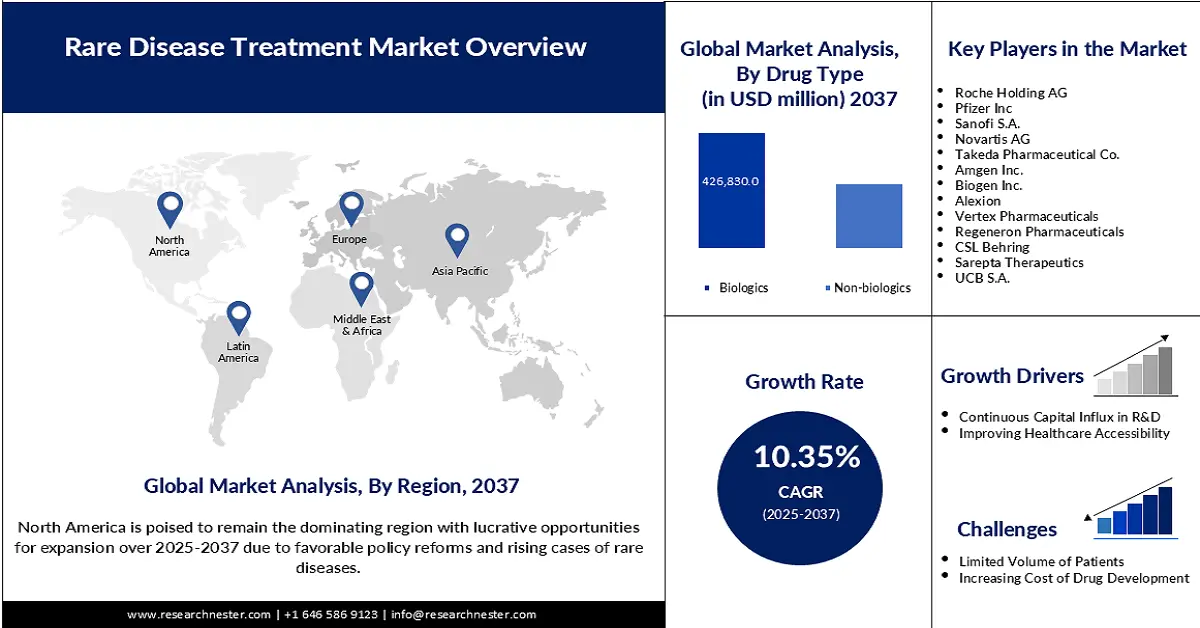
2024年,罕见病治疗市场规模为2322亿美元,预计到2037年底将达到7928亿美元,在预测期(即2025-2037年)内,复合年增长率为10.35%。2025年,罕见病治疗行业的规模估计为2431亿美元。
全球罕见病治疗市场的特点是患者群体规模有限但种类繁多。据全球罕见病委员会 (GRDC) 报告,到 2024 年,全球将有超过 3 亿人受到此类疾病的影响。在美国、日本和欧洲等主要地区,目标人群规模较小,但由于诊断能力的提高和基因突变遗传性的增强,累计患病人数持续增长。因此,约 70% 的罕见病发生在儿童身上。这些疾病的广泛性也推动了该领域的需求。截至 2024 年,全球已发现超过 7000 种罕见病,预计未来可能超过 10000 种,并且每年有 300 种新的罕见遗传病被添加到主要知识库中。
此外,2022年临床与经济评估研究所(ICER)发布的报告从支付方定价的角度概述了市场情况,指出一种针对仅有1万名患者的孤儿药,每年10万美元的价格可带来10亿美元的年收入。该报告还提到,由于认证孤儿药和基因/细胞疗法定价高昂,每位患者每年的治疗总成本通常超过100万美元。这些数据表明,最终用户和消费者的药品和服务成本正在上涨,同时也蕴藏着高价药品带来的丰厚利润。
罕见病治疗市场——增长动力与挑战
增长驱动因素
- 诊断和疾病认知方面的进展:根据美国国立卫生研究院 (NIH) 2025 年发表的一篇文章,80% 的罕见病被归类为遗传性疾病,其中 70% 和 3% 分别在儿童期和新生儿期发病。这表明基因组测序行业的爆炸式增长和进步是推动市场发展的主要因素。2022 年,美国国家医学图书馆 (NLM) 发表的一项荟萃分析也印证了这一点,该分析强调,全外显子组测序 (WES) 和全基因组测序 (WGS) 的合并诊断率分别比传统方法高出 0.3 和 0.4,为以往未接受治疗的病例带来了新的希望。
快速基因组测序在临床实践中的成本节约(2022)
国家 | 测序方法 | 主要成果 |
澳大利亚 | 快速全外显子组测序 | 避免手术和住院天数,节省成本 408,090 美元 |
香港 | 快速全外显子组测序 | 减少了566个住院日,节省了103万美元。 |
我们 | 快速全基因组测序 | 住院天数减少,净节省成本 128,555 美元 |
来源:美国国家医学图书馆
- 研发投入不断增长,产品线不断拓展:全球公共和私营机构都在大力投资于广泛的研究,以拓宽现有产品组合的应用领域。每年,全球罕见病治疗市场仅用于此类人群的资金就超过100亿美元。另一方面,这些努力催生的创新成果也取得了商业上的成功。例如,BridgeBio Pharma公司于2024年11月推出的用于治疗转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)的Attruby(acoramidis),仅在美国市场就为公司带来了3670万美元的销售额。
- 监管机构的支持力度加大:近期公共和认证管理体系的改革,通过提供补贴、激励措施和快速审批,确保了市场制造商未来的发展和显著扩张。这些措施为该行业创造了有利的环境,同时通过节省耗时的合规流程和专利到期成本,避免了财务和品牌价值的损失。近年来,FDA批准了20多种基因疗法,这标志着该领域取得了显著的里程碑式进展。例如,2024年9月,赛诺菲的Dupixent(用于治疗大疱性类天疱疮)获得了FDA的ODD(一次性使用许可)。
罕见病治疗市场关键领域的人口统计模式
美国罕见病发病率和患病率概述(2023 年)
地区/类别 | 估计患病率 |
美国整体情况 | 每十个人中就有一个人 |
马萨诸塞州 | 影响约10%的人口 |
华盛顿州 | 70-80万人获得研发 |
囊性纤维化 | 0.06% |
埃勒斯-当洛斯综合征 | 0.15% |
特纳综合征 | 0.02% |
资料来源: FDA、华盛顿州卫生部和 ISPOR
近期/正在进行的与罕见病治疗市场相关的开发项目
目前/近期/正在进行的RD药物临床试验
药品名称 | 适应症 | 赞助 | 研究阶段 | 要点 | 时间线 |
文格鲁斯塔特 | 戈谢病3型 | 赛诺菲健赞 | 第 3 阶段 | 口服底物减少疗法;评估长期安全性 | 有效(至2026年结束) |
赫勒酶(维斯特罗尼酶α) | 粘多糖贮积症 VII | Ultragenyx | 第四阶段 | 儿童患者的酶替代疗法 | 自2023年起持续进行 |
卢克斯图纳 | 遗传性视网膜疾病 | Spark Therapeutics | 后续/第四阶段 | RPE65突变相关视网膜营养不良的基因治疗 | 长期随访正在进行中 |
Elivaldogene autotemcel | 异染性脑白质营养不良 | 果园疗法 | 第 3 阶段 | 自体基因治疗,单次输注 | 已启动(预计2025年完工) |
Zynteglo | β-地中海贫血 | 蓝鸟生物 | 第三阶段/已批准 | 基因治疗,自体干细胞转导 | 已批准的、正在进行的研究 |
罗克塔维安 | 血友病A | 百奥玛林 | 第 3 阶段 | 因子VIII缺乏症的基因治疗 | 有效(至2026年结束) |
阿蒙迪斯 45 | 杜氏肌营养不良症 | Sarepta Therapeutics | 第 3 阶段 | 外显子跳跃反义寡核苷酸 | 进行中(2023-2025) |
奥利普达斯α | 酸性鞘磷脂酶缺乏症 | 赛诺菲健赞 | 第 3 阶段 | 尼曼-匹克病的酶替代疗法 | 最近完成 |
利布梅尔迪 | 异染性脑白质营养不良 | 果园疗法 | 第二/三阶段 | 基因疗法;已获EMA批准,美国批准待定 | 持续注册 |
来源: Clinicaltrials.gov
挑战
- 基础设施和可及性限制:许多经济体,特别是服务不足的地区,在获取市场上充足的产品和服务方面面临诸多障碍。资源、基础设施、标准化流程和诊断能力的匮乏,共同造成了患者就医方面的差距,最终导致该领域的应用受限。ICER 的报告也强调了这一问题,报告显示,截至 2022 年,90% 的患者缺乏经 FDA 批准的针对该疾病的治疗方案。
- 来自支付方的高定价压力:美国国家医学图书馆 (NLM) 2024 年的一项研究将用于治疗脊髓性肌萎缩症 (SMA) 的 Zolgensma 列为高价疗法,因为其单剂价格高达 210 万美元。因此,相当一部分支付方倾向于对如此高的价格实施严格的定价控制,并经常将这些疗法排除在医保报销范围之外。这不仅降低了罕见病治疗市场的可负担性和普及率,也缩小了先进疗法生产商的盈利空间。
罕见病治疗市场规模及预测:
| 报告属性 | 详细信息 |
|---|---|
|
基准年 |
2024 |
|
预测年份 |
2025-2037 |
|
复合年增长率 |
10.35% |
|
基准年市场规模(2024 年) |
2322亿美元 |
|
预测年份市场规模(2037 年) |
7928亿美元 |
|
区域范围 |
|
罕见病治疗市场细分:
药物类型细分分析
在分析期内,生物制剂预计将占据53.8%的市场份额,成为该领域最大的细分市场。其领先地位主要归功于精准医疗在疑难杂症治疗中日益普及。此外,作为该类别的一部分,生物类似药正逐渐成为政府主导的旨在降低药品可及性的项目的合格候选药物,使其成为该领域广泛认可和商业化的资产。此外,FDA于2024年5月批准Bkemv和Soliris作为罕见病的可互换生物类似药,也体现了该领域在合规性方面的卓越声誉。
疾病细分分析
预计2025年至2037年间,血液系统疾病领域将占据市场最高份额,达到45.4%。镰状细胞贫血症、血友病和阵发性睡眠性血红蛋白尿症等疾病的高发病率和高死亡率,尤其是在儿童群体中,是推动该领域占据主导地位的主要增长因素。根据全球疾病负担(GBD)研究,2000年至2021年间,全球新生儿中患有镰状细胞贫血症的人数和患病人数分别增长了13.7%和41.4%。另一方面,基因和细胞疗法的临床疗效已得到证实,吸引了更多资金投入到该领域新药的研发中。
患者细分分析
预计到2037年底,儿科年龄组将成为市场的主要患者群体,占据67.9%的市场份额。根据《儿科护理杂志》2023年发表的一篇文章,50%至75%的罕见病发生在儿童中。此外,美国国家医学图书馆(NLM)同年发布的另一项研究显示,2000年至2021年间,5岁以下儿童因镰状细胞病导致的年龄别死亡人数为81,100人,高于特定死因的死亡率。这些数据凸显了该行业将主要活动集中在这一领域的原因,巩固了其在该行业的领先地位。
我们对市场的深入分析涵盖以下几个方面:
部分 | 子段 |
药物类型 |
|
疾病 |
|
病人 |
|
给药途径 |
|
分销渠道 |
|

Vishnu Nair
全球业务发展主管根据您的需求定制此报告 — 联系我们的顾问,获取个性化见解和选项。
罕见病治疗市场——区域分析
北美市场洞察
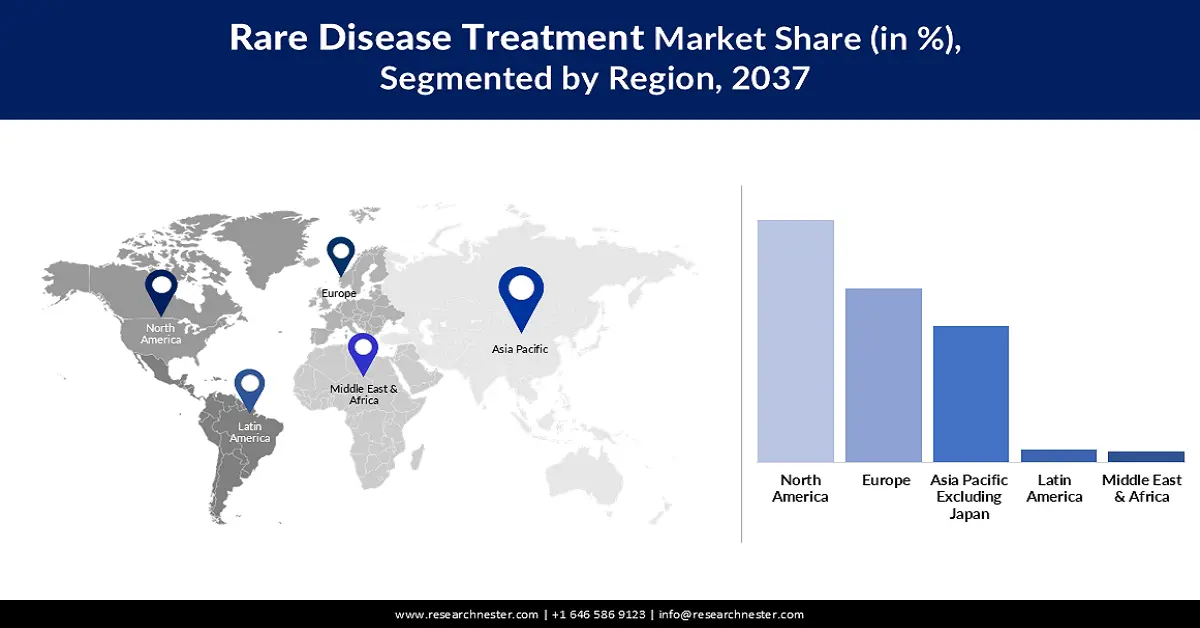
预计在评估期内,北美将以57.6%的市场份额占据主导地位。与其他太平洋地区相比,北美罕见病发病率较高是该地区市场增长的主要驱动因素。领先企业的存在和政府的支持政策也是该地区在该领域发展的有力推动力。作为此类支持的证据,美国食品药品监督管理局(FDA)2024年的一份报告强调了《孤儿药法案》的受益者及其对美国市场未来罕见病药物研发的积极影响。该法案允许FDA批准的新药获得高达300万美元的处方药用户费用豁免,以及长达7年的市场独占期。
美国罕见病患者群体的不断增长,促使该领域亟需扩大研发和生产能力。2024年FDA的报告证实了这一点,报告指出,美国罕见病患者人数已达3000万。此外,美国拥有先进的医疗体系,具备完善的基础设施,能够提供新一代诊断工具和服务,从而推动了该地区的市场扩张。同时,及时的产品审批、基于CRISPR技术的疗法的出现以及美国公众对罕见病的高度关注,也都在推动着该行业的发展。
加拿大约有十二分之一的人口患有罕见病,因此迫切需要有效的治疗方法和预防措施。另一方面,为了解决药物可及性差距问题,加拿大政府于2023年启动了《罕见病高价药物国家战略》,该战略通过补贴药品采购,既保障了患者的用药负担能力,也确保了制药企业的盈利能力。此外,市场上已有的药物约占加拿大药品销售额的十分之一,这表明加拿大药品市场环境良好。
亚太市场洞察
预计到2037年底,亚太市场将以11.5%的复合年增长率(CAGR)领跑全球。该行业的快速增长主要归功于对扩大罕见病诊疗能力的重视以及公共和私人医疗保健投资的不断增加。尤其是在中国、印度、越南和印度尼西亚,生物制剂产量最大化的趋势显著推动了亚太地区生物制剂行业的增长。此外,临床试验流程的简化和监管路径的更新也使得早期治疗方案能够大规模商业化,从而降低疾病进展导致的死亡率。
日本是亚太地区最具创新活力的中心之一,也是消费需求最高的国家之一。该国日益重视精准医疗,并雄心勃勃地致力于解决药品短缺问题,因此拨出大量医疗预算用于此类药物研发。政府大力扶持这一群体,其孤儿药制度的政策也印证了这一点。该制度提供10年市场独占权、研发补贴(涵盖50%的临床试验费用)以及比普通药物快6个月的审批流程。
在中国,随着罕见病病例数量的增加和集中式医疗体系的建立,市场正在稳步增长。此外,过去几年合规收购流程的改进吸引了大量投资,国内外企业也更积极地参与到这一领域。例如,2017年中国监管改革促使50多家跨国公司推出罕见病药物,这主要得益于孤儿药审批数量的显著增长,从改革前的每年3种增加到2022年的30多种。
关键区域的可行机遇
国家 | 要点 |
韩国 | 167种指定罕见病可获得100%报销 |
日本 | 将国家卫生预算的4%分配给疑难杂症研究 |
印度 | 7000万患者中,只有5%的人得到了正确的诊断。 |
资料来源: Research Nester报告
欧洲市场洞察
预计2025年至2037年间,欧洲罕见病治疗市场将占据重要地位。完善的报销机制和监管激励措施是该领域的主要增长动力,推动着该地区的持续扩张。根据欧洲议会2025年的报告,欧洲拥有3600万罕见病患者,这为相关产品创造了极具吸引力的商业环境。此外,政府为促进市场发展所做的努力还包括:于2024年10月启动欧洲罕见病研究联盟(ERDERA),该联盟将在2031年前投入4.473亿美元用于罕见病的预防、诊断和治疗研究。
德国拥有完善的医疗保健基础设施,能够满足日益增长的患者需求,预计其市场将引领欧洲市场。德国还拥有庞大的专科中心网络,包括ACHSE,该中心为早期诊断、治疗和患者护理提供支持。此外,随着德国日益重视研发先进药物和下一代生物制剂,预计未来几年该领域将快速发展。
法国罕见病治疗市场主要受法国国家卫生署(HAS)和团结基金预算拨款的驱动。全国范围内加强现有医疗设施以进行早期干预和诊断的努力也推动了该领域的蓬勃发展。未来几年,公共和私人对基因和细胞疗法的投资不断增加,预计将重塑法国现有的研发管线,同时吸引更多全球投资者投身其中。
市场可行机遇
倡议 | 要点 | 时间线 |
欧洲参考网络(ERN) | 1619个专科中心分布在382家医院,旨在应对罕见病、低发病率疾病和需要高度专业化医疗服务的复杂疾病和病症。 | 2017-2024 |
将ERN整合到国家医疗保健系统中的联合行动(JARDIN) | 从欧盟健康计划 (EU4Health) 获得 1760 万美元,以及从欧盟成员国获得 440 万美元,用于促进患者获得更便捷的医疗服务。 | 2024-2027 |
临床患者管理系统 2.0 | 欧盟委员会推出了一项新的信息技术平台,旨在为欧洲区域网络(ERN)提供更好的支持,从而减少患者出行需求。 | 2024 |
来源:欧洲议会
罕见病治疗市场主要参与者:
- 公司概况
- 商业战略
- 主要产品
- 财务业绩
- 关键绩效指标
- 风险分析
- 最新进展
- 区域影响力
- SWOT分析
全球罕见病治疗市场高度集中,辉瑞、罗氏、武田和赛诺菲等几家生物制药巨头占据了相当大的市场份额。这些公司高度重视通过收购孤儿药资格认定、基因和细胞疗法创新以及区域战略扩张来强化其在该领域的业务组合,以保持其在该领域净收入方面的主导地位。另一方面,亚太地区的几家主要企业正通过生物类似药途径和公私合作模式进军该领域。
以下是市场上的主要参与者名单:
公司名称 | 国家 | 收入份额(2037 年) |
罗氏控股公司 | 瑞士 | 8.9% |
诺华公司 | 瑞士 | 8.1% |
强生公司 | 我们 | 6.8% |
辉瑞公司 | 我们 | 6.5% |
赛诺菲公司 | 法国 | 6.2% |
武田药品工业株式会社 | 日本 | xx% |
安进公司 | 我们 | xx% |
百健公司 | 我们 | xx% |
阿莱克西翁 | 我们 | xx% |
Vertex制药公司 | 我们 | xx% |
再生元制药公司 | 我们 | xx% |
CSL Behring | 澳大利亚 | xx% |
Sarepta Therapeutics | 我们 | xx% |
优时比南非 | 比利时 | xx% |
益普生 | 法国 | xx% |
中外制药 | 日本 | xx% |
协和麒麟 | 日本 | xx% |
瑞迪博士实验室 | 印度 | xx% |
三星生物制剂 | 韩国 | xx% |
以下是各公司在全球市场的业务覆盖区域:
最新发展
- 2025 年 9 月, Alexion宣布 Koselugo(selumetinib)获得欧盟 (EU) 批准,用于治疗患有 1 型神经纤维瘤病 (NF1) 的成年患者的有症状、无法手术的丛状神经纤维瘤 (PN)。
- 2025年6月, CSL Behring公司的Andembry获得FDA批准,这是首个针对遗传性血管性水肿(HAE)的XIIa因子预防性治疗药物,适用于12岁及以上患者,每月给药一次。其独特的作用机制,经严格的临床试验验证,使其成为竞争激烈的市场中具有变革意义的选择。
- Report ID: 6667
- Published Date: Oct 06, 2025
- Report Format: PDF, PPT
- 探索关键市场趋势和洞察的预览
- 查看样本数据表和细分分析
- 体验我们可视化数据呈现的质量
- 评估我们的报告结构和研究方法
- 一窥竞争格局分析
- 了解区域预测的呈现方式
- 评估公司概况与基准分析的深度
- 预览可执行洞察如何支持您的战略




