注意力不足過動症市場展望:
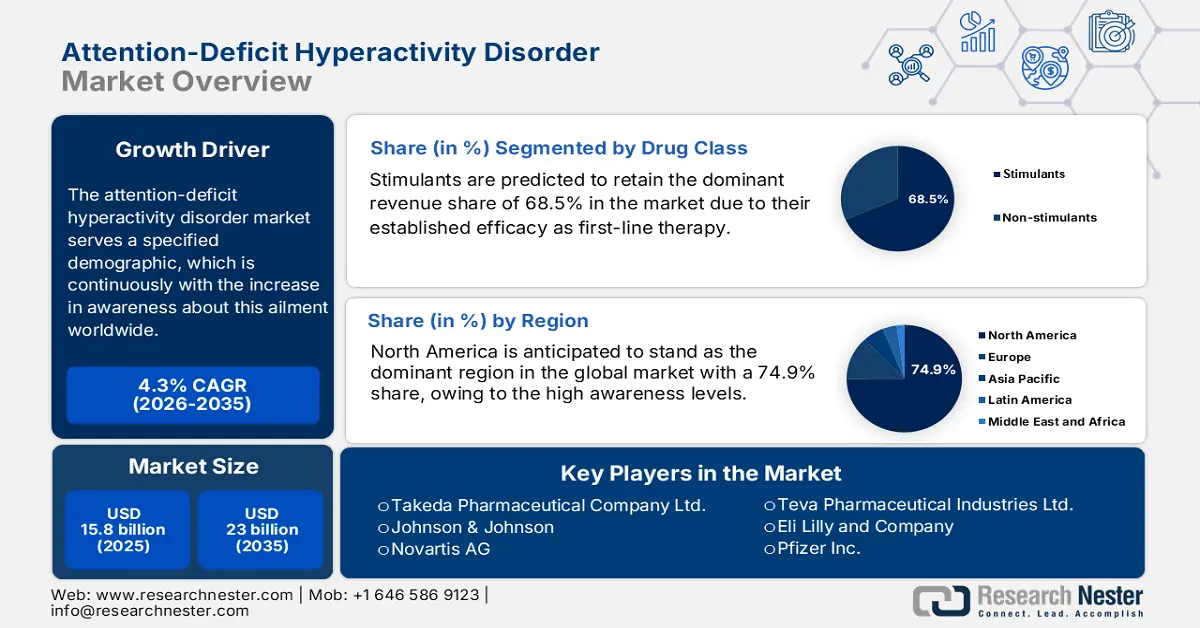
2025年,注意力不足過動症市場規模超過158億美元,預計到2035年底將達到230億美元,在預測期(即2026-2035年)內,複合年增長率為4.3%。 2026年,注意力不足過動症產業的規模估計為164億美元。
該市場服務於特定人群,而隨著全球對這種疾病的認知不斷提高,這一人群的需求也在持續增長。一項由美國國家醫學圖書館 (NLM) 支持的 2023 年薈萃分析證實了這一點,該分析揭示了日益嚴重的疾病負擔,並指出全球兒童和青少年中該疾病的發病率超過 8%。該分析還強調,注意力不足過動症 (ADHD) 在男孩中的盛行率是女孩的兩倍,其中註意力不集中型、過動型和混合型 ADHD 的發生率尤為突出。這一人口統計數據表明,市場對該領域有效的診斷和治療方案的需求日益增長。
由於市場供應鏈,尤其是治療藥物的供應鏈,很大程度上依賴專業化學品生產和原料藥外包,支付方在疾病管理方面的定價通膨持續上升。 2024年《臨床精神病學雜誌》的研究結果證實了這一點,該研究顯示,與未患此病的人相比,患有註意力缺陷過動症(ADHD)的人平均每年醫療費用增加了約1500美元。同樣,美國心理學會的另一項研究計算得出,這些患者終身醫療總支出在12,000美元至17,000美元之間。
注意力不足過動症市場—成長驅動因素與挑戰
成長驅動因素
- 隨著老年人口中註意力不足過動症(ADHD)患者數量的增長,ADHD的盛行率也不斷上升:最新數據顯示,ADHD並非兒童專屬,而是會持續到成年期,包括老年人群。因此,隨著全球人口老化,ADHD市場正迎來更大的消費群體,其中成年人和老年人的數量也不斷增加。此外,這一年齡層需要精準的診斷和量身定制的治療方案,這也推動了該領域更大的市場需求。西維吉尼亞大學研究團隊在2025年進行的一項研究證實了這一點,該研究發現,超過25%的美國成年人懷疑自己患有未確診的ADHD。該研究也強調了緩釋藥物在36-45歲和56-65歲年齡層中日益增長的需求。
- 研發活動日益活躍:隨著全球患者群體中疾病複雜性增加和發病率不斷上升,越來越多的公共和私營研發機構正大力投資於創新且更有效的藥物研發管線。這最終為市場創造了新的機會。歐盟臨床試驗註冊中心的數據進一步證實了研發項目數量的成長,該中心記錄了7,382項針對過動症患者的臨床試驗,佔2024年註冊試驗總數的16.6%以上。
- 非藥物解決方案的引入:隨著服用藥物的患者中藥物濫用風險的增加,市場上基於技術的療法正日益受到關注。這最終為該行業開闢了新的收入來源,並顯著提升了該類別的全球貿易價值。遵循同樣的思路,Tris Pharma於2024年4月與Braingaze簽署授權協議,在美國和加拿大成立了一家名為Tris Digital Health的新公司。該子公司專注於利用Braingaze的ADHD數位診斷平台,開發和商業化用於ADHD的數位診斷和治療產品。
注意力不足過動症患者群體趨勢分析:全球兒童和青少年註意力不足過動症盛行率分析
(2023年)
兒童(<12歲) | 亞型/診斷標準 | 患病率(%) | 95% 信賴區間 (CI) |
兒童(<12歲) | 注意力不集中亞型 | 33.2 | 27.6-39.3 |
過動衝動亞型 | 30.3 | 23.8-37.7 | |
混合型注意力不足過動症 | 31.4 | 24.6-39.1 | |
青少年(12-18歲) | 注意力不足過動症整體盛行率(25項研究) | 5.6 | 4-7.8 |
DSM-IV診斷標準 | 7.1 | 4.9-10.1 | |
DSM-IV-TR診斷標準 | 7.5 | 1.7-15.2 | |
DSM-V診斷標準 | 12.7 | 6.7-19.1 | |
ICD-10診斷標準 | 1.7 | 1.1-4.5 |
來源:美國國家醫學圖書館
臨床試驗和研究奠定了市場基礎並拓展了產品線
ADHD藥物目前/近期臨床試驗概述
藥品名稱(公司) | 試驗階段 | 目標人群 | 描述/目的 | 時間軸 | 目前狀態 |
NRCT-101SR(Neurocentria) | 第二/三階段 | 成人和兒童 | 成人和兒童過動症治療的療效和安全性評估 | 2023年及以後 | 研究藥物 |
Solriamfetol(Axsome Therapeutics) | 第二階段 | 成年人(18-65歲) | 針對過動症症狀的對照劑量優化研究 | 2021-2023 | 顯示出令人鼓舞的結果;計劃進行兒科用藥試驗 |
Centanafadine(大塚) | 第三階段 | 成年人 | 療效和安全性試驗,包括合併焦慮症 | 2025-2027 | 初步結果積極;計劃向FDA申請新藥上市許可。 |
AK0901(ArkBio) | 第三階段 | 兒童(6至12歲) | 測試功效和安全性 | 2021-2025 | 已獲FDA批准上市,並取得NMPA優先審查資格 |
資料來源:Clinicaltrials.gov 和公司新聞稿
挑戰
- 嚴格的管制藥品法規:許多用於治療過動症的藥物在多個關鍵領域被列為受管制藥品,這可能會阻礙某些藥物在市場上的廣泛普及。這也對生產商和分銷商提出了嚴格的儲存、追蹤和分銷要求,增加了營運成本和複雜性。最終,這限制了藥品的銷售管道,並給處方醫生帶來了額外的監管障礙,間接抑制了市場規模。
- 社會污名和有限的診斷能力:市場的主要限制不僅是經濟障礙,還有公共衛生基礎設施的不足。世界衛生組織(世衛組織)也強調了全球精神健康服務(包括診斷)的缺口,尤其是在中低收入國家。此外,訓練有素的臨床醫生嚴重短缺,導致注意力不足過動症(ADHD)的診斷延誤,在價格成為考慮因素之前,就已經降低了藥物的使用率。
注意力不足過動症市場規模及預測:
| 報告屬性 | 詳細資訊 |
|---|---|
|
基準年 |
2025 |
|
預測年份 |
2026-2035 |
|
複合年增長率 |
4.3% |
|
基準年市場規模(2025 年) |
158億美元 |
|
預測年份市場規模(2035 年) |
230億美元 |
|
區域範圍 |
|
注意力不足過動症市場區隔:
藥物類別細分分析
預計到2035年底,興奮劑仍將維持68.5%的市場份額,佔據主導地位。其領先地位主要得益於興奮劑作為第一線療法的確切療效。 2023年3月發表的一項研究表明,2013年至2022年間,接受興奮劑治療的過動症患者比例始終高於非興奮劑患者,在61%至64%之間波動。此外,諸如緩釋哌甲酯和安非他明等改良製劑的研發,不僅療效更持久,而且濫用風險更低,進一步鞏固了興奮劑在該領域的領先地位。
人口統計細分分析
在註意力不足過動症(ADHD)市場中,成人群體預計將以最快的速度成長,並在評估期內佔據55.4%的市場份額。這一增長主要得益於成人ADHD診斷率的提高、公眾意識的增強以及治療指南的擴展。猶他大學發布的一份報告證實了這一人口結構的變化,該報告顯示,2020年至2023年間,美國成年人ADHD的發生率從6.1%上升至10.2%,確診病例總數達到870萬例。此外,該年齡層越來越傾向於尋求適合其年齡的診斷和治療,這將推動未來藥物創新和藥物消費的成長。
分銷通路細分分析
預計在所討論的時間範圍內,零售藥局將以52.8%的市佔率佔據主導地位。其廣泛的分佈和便利的購買管道使其成為患者取得常用藥物及相關產品的主要途徑。零售藥局還提供便利性、即時供貨和個人化的客戶服務,這些對於持續堅持ADHD治療至關重要。此外,這些分銷管道通常也是病患教育和支援的重要接觸點,有助於彌合處方與有效用藥之間的差距,並在該領域建立強大的供應生態系統。
我們對全球市場的深入分析涵蓋以下幾個面向:
部分 | 子段 |
藥物類別 |
|
人口統計數據 |
|
性別 |
|
分銷管道 |
|
產品類型 |
|

Vishnu Nair
全球業務發展主管根據您的需求自訂本報告 — 與我們的顧問聯繫,獲得個人化的洞察與選項。
注意力不足過動症市場—區域分析
北美市場洞察
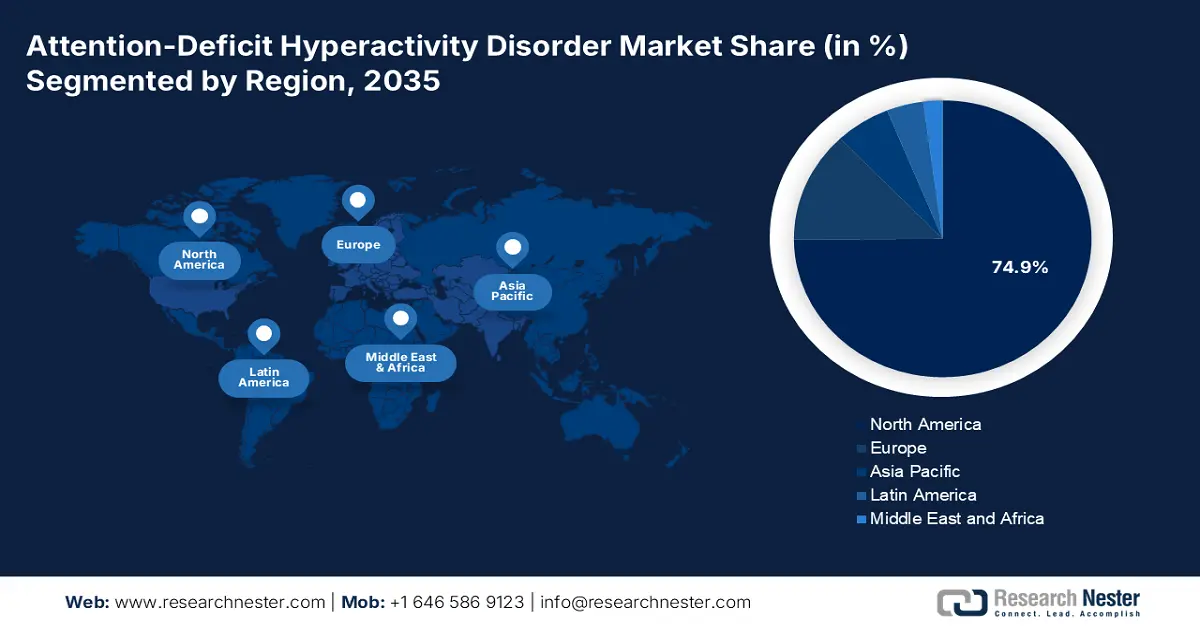
預計在分析期內,北美將以74.9%的最高市場份額,繼續在全球注意力不足過動症(ADHD)市場佔據主導地位。該地區在該領域的領先地位主要得益於其較高的認知水平、先進的醫療基礎設施以及龐大的醫療支出。此外,政府為普及診斷能力和藥物治療所做的努力也推動了ADHD藥物的普及應用。例如,2024年9月,美國緝毒局將ADHD藥物Vyvanse及其仿製藥的生產限額提高了24%。
完善的保險和報銷體系,加上普遍適用的標準化法規,共同使美國成為市場上臨床進步的典範。此外,成人多動症的認知度不斷提高,以及對兒童早期診斷的日益重視,也促進了消費者群體的持續成長。美國國家衛生統計中心快速調查系統的數據也印證了這一日益增長的流行病學特徵:僅2023年,美國成人多動症的診斷數量就超過1550萬例,其中50%的病例確診時年齡在18歲及以上。
強而有力的政府措施和全球領先製藥公司的積極參與,鞏固了加拿大在北美市場的地位。隨著加拿大透過各項措施和公共衛生項目,大力推動早期診斷和綜合治療,該領域的需求顯著增長。此外,不斷加大的研發投入和公私合作計畫(PPP)正在推動該領域的創新,而政府的持續撥款也為此提供了有力支持。
亞太市場洞察
預計到2035年底,亞太地區將成為全球注意力不足過動症(ADHD)市場成長最快的地區。該地區在該領域的快速發展得益於公眾意識的提高、醫療保健服務的改善以及診斷能力的提升。快速的都市化也有助於及早發現易感兒童和成人的ADHD。另一方面,對研發和生產先進治療方案的日益重視,也為該產品創造了有利可圖的商業環境。此外,診斷能力的現代化和醫療保健服務的持續投入,也鞏固了該地區未來幾年的市場地位。
中國是亞太市場成長的關鍵驅動力,受益於日益增強的心理健康意識和政府為改善臨床服務所做的努力。中國擁有龐大的兒童人口,且成人對注意力不足過動症(ADHD)症狀的認知度不斷提高,因此全國對有效療法的需求正在迅速增長。另一方面,中國雄心勃勃地致力於透過建立集中化的醫療體系來改善藥物可近性,這使得更多患者能夠及時獲得治療。此外,持續的研究以及與全球製藥公司的合作也進一步推動了創新型ADHD療法的引入。
印度正逐漸成為亞太地區注意力不足過動症(ADHD)仿製藥市場的典範,以提供價格合理的仿製藥。憑藉著覆蓋城市和半城市地區的廣泛醫療服務,印度正在推動藥物和數位療法的蓬勃發展。此外,政府針對心理健康的各項措施以及公共教育活動,有助於消除社會歧視,鼓勵早期介入。同時,政府部門也越來越多地參與公私合作項目,也為患者開發出更多先進的治療方案。
針對特定國家的商業策略/成功案例
國家 | 重點 | 時間軸 |
印度 | 賴右苯丙胺二甲磺酸膠囊已獲得FDA批准,顆粒劑公司進一步加強了其ADHD產品組合。 | 2025年1月 |
中國 | ArkBio敦促國家藥品監督管理局優先審查其新藥申請Azstarys。 | 2025年6月 |
韓國 | INTHETECH計畫在2025年國際消費性電子展(CES 2025)上展示EYAS,重新介紹其在治療注意力不足過動症(ADHD)方面的功能。 | 2025年1月 |
資料來源:公司新聞稿
歐洲市場洞察
在2026年至2035年期間,歐洲可望成為全球注意力不足過動症(ADHD)市場第二大市場。完善的醫療保健體系、健全的監管框架以及人們對神經發育障礙日益增長的認知,是推動該地區在該領域持續增長的主要因素。此外,已開發國家正越來越多地在學校和基層醫療機構實施早期篩檢項目,從而帶來更多資金流入。目前,興奮劑和非興奮劑類藥物的廣泛接受度,以及結合藥物治療和行為療法的綜合護理模式,都為該領域的發展提供了有利條件。
英國在註意力不足過動症(ADHD)領域的區域發展中處於領先地位。該國在該領域的重要性主要歸功於不斷提高的診斷率、強有力的公共醫療保健支持以及各年齡層對該疾病日益增長的認知。英國國家醫療服務體系(NHS)在提供ADHD評估和一系列治療方案方面發揮關鍵作用。劍橋大學研究人員於2024年發表的一項研究證實了公共支出的增長,該研究顯示,英格蘭和威爾斯的NHS在ADHD的首次專科評估上的總費用為2680萬美元。此外,後續護理的年度支出也高達1,630萬美元。
隨著人們對成人注意力不足過動症(ADHD)的認識不斷提高,德國的ADHD市場患者群體也不斷擴大。因此,國內外製藥和醫療技術巨頭紛紛抓住這一機遇,積極開拓市場,以滿足日益增長的專業服務需求。 2024年11月,GAIA與MEDICE簽署授權協議,在德國商業化其個人化、全自動數位療法Attexis,用於ADHD患者的症狀管理。此外,持續的研究、心理健康倡導以及新型標靶藥物的上市,也推動了德國ADHD產品的持續成長。
國家政府省份
國家 | 計劃/分配 | 年 |
英國 | 撥款1100萬美元,支持1200所小學的30萬名患有自閉症、過動症和閱讀障礙的兒童。 | 2025 |
義大利 | 愛爾蘭藥品管理局 (AIFA) 已批准將美替芬尼托 (Medikinet) 納入國家醫療服務體系 (SSN) 的報銷範圍,用於治療新確診的成人注意力不足過動症 (ADHD)。 | 2023 |
德國 | ZNS發起了一項全國性的資訊宣傳活動,旨在提高人們對心理健康和大腦健康(包括過動症和癡呆症)的認識。 | 2024 |
資料來源:GOV.UK、AIFA 和 SPIZ
注意力不足過動症市場主要參與者:
- 強生公司
- 公司概況
- 商業策略
- 主要產品
- 財務業績
- 關鍵績效指標
- 風險分析
- 最新進展
- 區域影響力
- SWOT分析
- 諾華公司
- 輝瑞公司
- 禮來公司
- 梯瓦製藥工業股份有限公司
- Viatris 公司(包括 Mylan)
- 太陽製藥工業有限公司
- Amneal製藥公司
- Hikma製藥有限公司
- Tris Pharma, Inc.
- Supernus Pharmaceuticals, Inc.
- 奧羅賓多製藥有限公司
- 雷迪實驗室有限公司
- Impax Laboratories, LLC
- Noven Pharmaceuticals, Inc.
- 優時比南非
- Corium公司
- Neos Therapeutics, Inc.
- 羅德斯製藥有限公司
- 魯賓有限公司
注意力不足過動症(ADHD)市場的競爭格局正在迅速變化,先行者正透過開發數位療法,拓展其產品線,不再局限於傳統藥物。 Akili Interactive 於 2021 年 7 月發布的 EndeavorRx 全新遊戲功能便是一個例證。 EndeavorRx 是當時唯一一款獲得 FDA 批准的兒童 ADHD 電子遊戲療法,標誌著該領域正朝著非藥物、技術驅動的解決方案轉型,旨在透過引人入勝且經臨床驗證的遊戲玩法來改善注意力。
這些關鍵人物包括:
最新動態
- 2024年11月, Lupin公司獲得美國食品藥物管理局(FDA)對其單一實體安非他明緩釋膠囊混合鹽的簡略新藥申請(ANDA)批准。此混合物由糖酸右旋安非他明、天冬胺酸安非他明一水合物、硫酸右旋安非他明和硫酸安非他明組成,旨在治療6歲及以上成人和兒童患者的注意力不足過動症(ADHD)。
- 2024年5月, Tris Pharma公司取得上市許可,其每日一次的緩釋口服懸浮液ONYDA XR(鹽酸可樂定)可在夜間服用。此藥適用於治療6歲以上兒童患者的注意力不足過動症(ADHD),可作為單一療法或與已核准的中樞神經系統(CNS)興奮劑藥物合併使用。
- Report ID: 8088
- Published Date: Sep 11, 2025
- Report Format: PDF, PPT
- 探索关键市场趋势和洞察的预览
- 查看样本数据表和细分分析
- 体验我们可视化数据呈现的质量
- 评估我们的报告结构和研究方法
- 一窥竞争格局分析
- 了解区域预测的呈现方式
- 评估公司概况与基准分析的深度
- 预览可执行洞察如何支持您的战略




