Perspectives du marché du traitement de la gonorrhée :
Le marché des traitements contre la gonorrhée représentait 1,39 milliard de dollars en 2025 et devrait atteindre 2,8 milliards de dollars d'ici fin 2035, avec un taux de croissance annuel composé (TCAC) de 7,2 % sur la période 2026-2035. En 2026, ce marché était estimé à 1,49 milliard de dollars.
Le marché mondial des traitements contre la gonorrhée est en constante expansion. Selon l'OMS, environ 82,4 millions de nouveaux cas ont été recensés dans le monde en 2020. D'après un rapport des Centres pour le contrôle et la prévention des maladies (CDC), on observe une augmentation progressive des cas déclarés aux États-Unis, avec 710 151 cas enregistrés en 2021, soit 214 cas pour 100 000 habitants. Cette forte croissance du nombre de patients influence la demande en antibiotiques et en outils de diagnostic, et accroît la pression sur la chaîne d'approvisionnement en principes actifs pharmaceutiques et en produits médicaux. Cette chaîne d'approvisionnement est fortement dépendante des matières premières provenant de plateformes logistiques asiatiques, notamment de Chine et d'Inde.
Cas déclarés et taux de cas déclarés par État, classés par taux, États-Unis, 2021
Rang | État | Cas | Taux pour 100 000 habitants |
1 | Mississippi | 12 617 | 427,7 |
2 | Dakota du Sud | 3 258 | 363,9 |
3 | Louisiane | 16 390 | 354,5 |
4 | Alabama | 16 191 | 321.3 |
5 | Caroline du Sud | 16 052 | 309.2 |
6 | Géorgie | 31 996 | 296,3 |
7 | Caroline du Nord | 28 612 | 271.2 |
8 | Arkansas | 8 176 | 270,2 |
9 | Nevada | 8 488 | 270.0 |
10 | Alaska | 1 977 | 269,8 |
11 | Tennessee | 18 768 | 269.1 |
12 | Oklahoma | 10 273 | 257,7 |
13 | Missouri | 15 714 | 254,8 |
14 | Arizona | 18 426 | 253.2 |
15 | Illinois | 30 454 | 240,3 |
16 | New Mexico | 5 080 | 240.1 |
17 | Ohio | 27 838 | 236,3 |
18 | Californie | 91 461 | 233.1 |
19 | Dakota du Nord | 1 735 | 223,9 |
20 | Texas | 64 623 | 218,9 |
21 | Michigan | 21 954 | 218,4 |
22 | New York | 43 048 | 217.0 |
— | TOTAL AMÉRICAIN | 710 151 | 214.0 |
Source : CDC

Marché du traitement de la gonorrhée : facteurs de croissance et défis
Facteurs de croissance ?
Prévalence croissante et augmentation du nombre de patients : Avant la pandémie de COVID-19, l’incidence de la chlamydiose augmentait de 1 % par mois (IC à 95 % : 1,01-1,01 ; RR = 1,01) et était supérieure de 3 % par tranche de 1 000 $ supplémentaires de financement des maladies infectieuses (IC à 95 % : 1,01-1,06 ; RR = 1,03) par habitant. L’incidence de la gonorrhée augmentait de 1 % par trimestre (IC à 95 % : 0,98-1,05 ; RR = 1,01) et l’investissement dans les maladies infectieuses par habitant était supérieur de 6 % (IC à 95 % : 1,01-1,11 ; RR = 1,06). La hausse de l’incidence de la chlamydiose reflète une diminution moins marquée des cas de chlamydiose dans les unités de santé publique. Les Instituts nationaux de la santé (NIH) des États-Unis et la Fondation Bill & Melinda Gates figurent parmi les principaux investisseurs dans la recherche et le développement (R&D) en santé. Ils suivent de près les tendances de financement des projets de développement de produits, de vaccins et de tests de diagnostic pour les infections sexuellement transmissibles (IST) courantes, telles que la gonorrhée, la syphilis, la chlamydiose, l'hépatite B, le papillomavirus humain (VPH), l'herpès génital et la trichomonase. Selon le rapport AVAC 2024, la majeure partie des financements (51 %) a été consacrée à la R&D sur le VPH, tandis que la gonorrhée et la syphilis comptaient parmi les maladies les plus financées en 2022.
Série chronologique interrompue des cas trimestriels confirmés de gonorrhée chez les adolescents âgés de 13 à 19 ans pendant la pandémie de COVID-19 en Ontario, au Canada.
Variables | aRR | IC à 95 % |
Temps | 1.01 | 0,98, 1,05 |
Pandémie | 0,51 | 0,04, 7,22 |
Le temps et la pandémie | 1.01 | 0,91, 1,13 |
Financement des CIM | 1.06 | 1.01, 1.11 |
Financement et temps de l'ICD | 1,00 | 0,99, 1,00 |
Changement de niveau : financement des CIM et pandémie | 1.11 | 0,92, 1,33 |
Changement de pente : Temps, pandémie et financement des DAI | 0,99 | 0,99, 1,00 |
- Dépenses publiques et de Medicare pour le développement de médicaments et les essais cliniques : selon le rapport AVAC 2024, 18 millions de dollars ont été consacrés à la recherche et au développement d’un vaccin contre la gonorrhée, 50 millions au vaccin contre le VPH, 9 millions au vaccin contre la syphilis, 3,5 millions au vaccin contre l’herpès génital, 8 millions au vaccin contre la chlamydiose et 2,8 millions au vaccin contre l’hépatite B. Sur le total des investissements dans le diagnostic, 66 % ont été alloués à la recherche et au développement de vaccins contre plusieurs pathogènes (dont la gonorrhée, la chlamydiose, la syphilis et l’herpès génital). 103 millions de dollars ont été consacrés à la recherche sur le diagnostic et les vaccins contre les IST, dont 6,8 millions (7 %) à la recherche diagnostique et 93 millions (90 %) à la recherche vaccinale. Les NIH ont financé 73 % des investissements dans la recherche et le développement de vaccins. De plus, le Centre d'immunologie translationnelle de l'Institut des sciences biomédicales de l'Université d'État de Géorgie a reçu en septembre 2022 une subvention fédérale de 4,9 millions de dollars sur cinq ans pour étudier Neisseria gonorrhoeae et l'immunité nutritionnelle qui empêche la croissance microbienne en affamant les agents pathogènes envahissants.
Les médicaments contre la gonorrhée sont considérés comme faisant partie de la partie D de Medicare. Le client paie 25 % du coût à titre de coassurance pour les médicaments génériques et de marque jusqu'à ce que les dépenses d'achat indicatives à la charge du patient ou le prix du payeur atteignent 2 000 USD en 2025 et les 2 100 USD estimés en 2026 pour les médicaments couverts par la partie D.
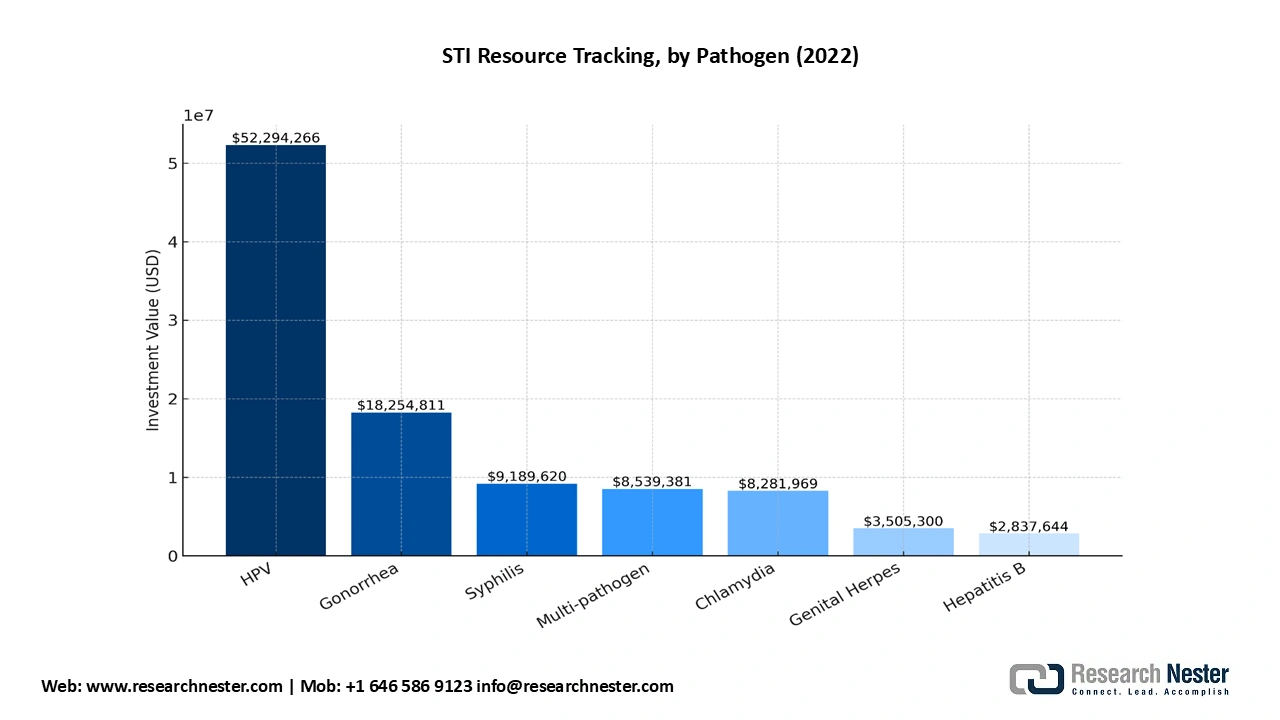
Source : AVAC
Résumé de l'essai clinique
- NCT04010539 (Gépotidacine vs Ceftriaxone + Azithromycine)
Champ | Détail |
Titre officiel | Étude de phase III, randomisée, multicentrique et ouverte menée chez des adolescents et des adultes, comparant l'efficacité et l'innocuité de la gépotidacine à celles de la ceftriaxone associée à l'azithromycine dans le traitement de la gonorrhée urogénitale non compliquée causée par Neisseria gonorrhoeae |
Sponsor / Responsable | GlaxoSmithKline (GSK) |
Type d'étude | Interventionnel (Essai clinique) |
Phase | Phase 3 |
Conception (globale) | randomisé, multicentrique, ouvert, avec répartition parallèle |
Allocation | randomisé |
Objectif principal | Traitement |
Condition / indication | Gonorrhée urogénitale non compliquée (Neisseria gonorrhoeae) |
Interventions / bras | Expérimental : Gepotidacine - voie orale : 3000 mg (4 × 750 mg comprimés) à l'inclusion (jour 1) sur le site ; deuxième dose orale de 3000 mg (4 × 750 mg) auto-administrée 10 à 12 heures plus tard. |
Mesure du critère d'évaluation principal | Nombre de participants présentant une éradication bactérienne de N. gonorrhoeae confirmée par culture au niveau urogénital lors de la visite de contrôle (jours 4 à 8). (Mesure initiale → Contrôle) |
Principaux critères d'évaluation secondaires | Éradication bactérienne confirmée par culture au niveau rectal (jours 4 à 8 du TOC) ; au niveau pharyngé (jours 4 à 8 du TOC) ; nombre de participants présentant des EIG et des EIG (jusqu'à 21 jours) ; modifications par rapport aux valeurs initiales des paramètres hématologiques et de chimie clinique ; résultats des analyses d'urine ; signes vitaux. |
Critères d'admissibilité - Âges | ≥ 12 ans |
Critères d'admissibilité - Sexe | Tous les sexes sont éligibles |
Inscriptions (réelles) | 628 participants (effectif réel) |
Début des études (réel) | 21 octobre 2019 |
Achèvement primaire (réel) | 10/10/2023 |
Achèvement des études (réel) | 10/10/2023 |
Nombre de sites/emplacements | 51 localités (les pays mentionnés dans le document comprennent : les États-Unis, l’Australie, l’Allemagne, le Mexique, l’Espagne, le Royaume-Uni – plusieurs villes par pays, comme indiqué) |
Exemples clés d'exclusion | Épididymite/orchite en cours ; infection à Chlamydia trachomatis suspectée/confirmée nécessitant un traitement qui ne peut être reporté ; IMC ≥ 40 ou ≥ 35 avec comorbidité ; hypersensibilité connue aux médicaments de l’étude ; immunodéficience ; insuffisance rénale/hépatique significative ; exposition récente à un produit expérimental ; allongement de l’intervalle QT ou utilisation de médicaments allongeant l’intervalle QT ; grossesse/allaitement. |
Exemples d'inclusion notables | Suspicion clinique d'infection gonococcique urogénitale (ou culture/NAAT positive récente jusqu'à 5 à 7 jours auparavant) ; volonté d'éviter toute activité sexuelle ou d'utiliser des préservatifs pendant toute la durée du traitement ; poids corporel > 45 kg ; capable de donner un consentement éclairé/un assentiment. |
Surveillance de la sécurité | TEAE/SAE capturés jusqu'à 21 jours ; analyses de laboratoire, analyses d'urine, signes vitaux, dépistage ECG/spécification QTc dans les critères d'exclusion. |
Résultats publiés / dates | Première soumission des résultats : 1er mai 2024 ; première publication des résultats : 30 mai 2024 ; dernière mise à jour : 30 mai 2024 ; dernière vérification : avril 2024 |
Note réglementaire/juridictionnelle | Études portant sur un médicament réglementé par la FDA américaine (signalement d'enregistrement) |
Autres identifiants | Autres numéros d'identification de l'étude : 116577 ; numéro EudraCT : 2018-001780-23 |
Commentaires / notes complémentaires (tirées du dossier) | Essai de phase 3 ouvert de non-infériorité ; le schéma comparateur utilisé était une dose unique de ceftriaxone IM 500 mg + azithromycine 1000 mg ; les résultats et les documents justificatifs (protocole, SAP) sont disponibles via l’enregistrement ClinicalTrials.gov et le portail de partage de données du promoteur. |
Source : ClinicalTrials.gov
2. NCT05027516 (ResistAZM)
Champ | Valeur |
Titre de l'étude (abrégé) | Essai comparatif de la ceftriaxone associée à l'azithromycine versus la ceftriaxone seule pour le traitement de la gonorrhée (ResistAZM) |
Titre officiel | Essai contrôlé randomisé en ouvert comparant l'effet de la ceftriaxone associée à l'azithromycine versus la ceftriaxone seule pour le traitement de Neisseria gonorrhoeae sur le résistome |
Sponsor / Responsable | Institut de médecine tropicale, Belgique |
Type d'étude | interventionnel |
Phase | Phase 4 |
État de l'étude (d'après le dossier) | Terminé (Résultats publiés) - Dernière mise à jour : 02/08/2024 |
Résumé | Essai contrôlé randomisé incluant 42 hommes atteints de gonorrhée à N. gonorrhoeae suivis à la clinique IST/VIH de l'ITM ; randomisés selon un ratio 1:1 pour recevoir soit la ceftriaxone seule, soit la ceftriaxone associée à l'azithromycine ; suivi au jour 14 pour évaluer la guérison et surveiller le microbiome/résistome. Le critère d'évaluation principal est la différence d'abondance des gènes de résistance dans le microbiome rectal au jour 14. |
Conditions | Neisseria gonorrhoeae (gonorrhée) |
Autres numéros d'identification de l'étude | ITM202101 |
Début des études (réel) | 17 janvier 2022 |
Achèvement primaire (réel) | 2022-05-09 |
Achèvement des études (réel) | 2022-05-09 |
Inscriptions (réelles) | 42 |
Nombre de sites par pays | 1 site — Institut de médecine tropicale, Anvers, Belgique |
Âges admissibles | 18 ans et plus |
Sexes éligibles | Homme (inclusion : sexe masculin à la naissance) |
Des volontaires en bonne santé sont-ils acceptés ? | Non |
Éligibilité fondée sur le sexe | Oui - l'inclusion est limitée aux garçons à la naissance |
Allocation | randomisé |
Modèle interventionnel | Affectation parallèle |
Masquer | Quadruple (Participant ; Prestataire de soins ; Chercheur ; Évaluateur des résultats) |
Objectif principal | soins de soutien |
Interventions / bras (détails) | Bras 1 (Comparateur actif - Rocephin) : Ceftriaxone 1 g + lidocaïne 35 mg, injection intramusculaire (dose unique). |
Mesure du critère d'évaluation principal | Déterminants de la résistance aux macrolides : rapport des nombres moyens de lecture des déterminants de résistance aux macrolides dans les échantillons anorectaux prélevés au jour 14 entre le groupe ceftriaxone/azithromycine et le groupe ceftriaxone. Période : jour 14. |
Principaux critères d'évaluation secondaires | Lire le nombre de déterminants de résistance pour chaque classe d'antibiotiques non macrolides (jour 14) ; acquisition de la résistance phénotypique à l'azithromycine par N. gonorrhoeae dans le morbidostat après exposition à des extraits d'ADN de Neisseria commensale de chaque groupe de traitement (jour 0 et jour 14). |
Points saillants de l'inclusion (tirés du dossier) | Capable et disposé à fournir un consentement éclairé écrit ; sexe masculin à la naissance ; ≥ 18 ans ; diagnostic confirmé d'urétrite, de proctite ou de pharyngite due à N. gonorrhoeae (symptomatique ou asymptomatique) par NAAT positif ou (pour l'urétrite) coloration de Gram/bleu de méthylène positive. |
Points saillants de l'exclusion (du dossier) | Utilisation de tout antibiotique macrolide au cours des 6 derniers mois ; contre-indications/allergie connues à la ceftriaxone, à l’azithromycine ou à la lidocaïne ; présence d’une autre affection/autre IST susceptible de nécessiter un autre antibiotique lors de l’inclusion, selon l’évaluation du médecin traitant. |
plan de partage des données IPD | Non (Plan pour les données individuelles des participants : Non) |
Dates de publication des résultats (d'après le registre) | Résultats soumis pour la première fois : 05/06/2023 ; Résultats soumis pour la première fois répondant aux critères de contrôle qualité : 15/02/2024 ; Résultats publiés pour la première fois : 02/08/2024 ; Dernière mise à jour : 02/08/2024 ; Dernière vérification : février 2024. |
Notes / commentaires (tirés du disque) | Le critère d’évaluation principal porte sur le résistome (déterminants de résistance aux macrolides) dans les échantillons anorectaux au jour 14 ; petit ECR (n=42) conçu pour évaluer l’impact du microbiome/résistome de l’ajout d’azithromycine au traitement par ceftriaxone. |
Source : ClinicalTrials.gov
Défis
Les restrictions tarifaires imposées par les systèmes de santé publics limitent la rentabilité sur plusieurs marchés développés. En Allemagne, le système d'assurance maladie obligatoire a plafonné les remboursements d'antibiotiques, réduisant ainsi les marges bénéficiaires des fournisseurs. Ces contraintes rendent difficile le retour sur investissement en recherche et développement pour les fabricants. Par ailleurs, en privilégiant la maîtrise des dépenses publiques, ces réglementations tarifaires découragent l'entrée sur le marché et l'innovation dans le domaine des traitements contre la gonorrhée. Selon la Commission européenne, ces politiques entravent particulièrement le lancement de nouveaux médicaments dans des domaines thérapeutiques tels que les IST.
Taille et prévisions du marché des traitements contre la gonorrhée :
| Attribut du rapport | Détails |
|---|---|
|
Année de base |
2025 |
|
Année prévisionnelle |
2026-2035 |
|
TCAC |
7,2% |
|
Taille du marché de l'année de référence (2025) |
1,39 milliard de dollars américains |
|
Taille du marché prévisionnelle pour l'année 2035 |
2,8 milliards de dollars américains |
|
Portée régionale |
|
Segmentation du marché des traitements contre la gonorrhée :
Analyse segmentaire des classes de médicaments
Les antibiotiques dominent le marché du traitement de la gonorrhée, avec une part de marché mondiale de 65,2 % en 2030. Ce marché est principalement porté par l'amélioration constante de l'efficacité clinique et la reconnaissance internationale d'agents tels que les céphalosporines et les macrolides. Selon les rapports de l'OMS et des CDC, ces agents sont largement utilisés en bithérapie en raison de la résistance croissante aux antimicrobiens. L'innovation dans le développement de nouveaux médicaments façonne le marché du traitement de la gonorrhée et les perspectives thérapeutiques futures, notamment pour les cas de multirésistance.
Analyse segmentaire par type de traitement
La bithérapie domine le marché du traitement de la gonorrhée et devrait représenter 55,2 % des parts de marché, principalement grâce à l'association de ceftriaxone et d'azithromycine. Elle demeure le traitement de première intention en raison de son efficacité prouvée contre les souches de Neisseria gonorrhoeae. Selon un rapport de l'OMS et du CDC, ce traitement permet de lutter contre la résistance croissante aux antimicrobiens en exploitant deux mécanismes d'action différents, réduisant ainsi le risque de réinfection et d'échec thérapeutique.
Notre analyse approfondie du marché mondial du traitement de la gonorrhée comprend les segments suivants : ?
Segment | Sous-segment |
Classe de médicaments |
|
Type de traitement |
|
Voie d'administration |
|
Type d'infection |
|

Vishnu Nair
Responsable du développement commercial mondialPersonnalisez ce rapport selon vos besoins — contactez notre consultant pour des informations et des options personnalisées.
Marché du traitement de la gonorrhée - Analyse régionale
Aperçu du marché nord-américain
L'Amérique du Nord domine le marché du traitement de la gonorrhée et devrait atteindre 39,3 % en raison de l'augmentation du nombre de patients déclarant une gonorrhée résistante aux antimicrobiens. Face à cette hausse du nombre de patients, des investissements accrus sont nécessaires pour développer des diagnostics et des traitements efficaces. L'adoption croissante des tests d'amplification des acides nucléiques (TAAN) et les investissements dans les antibiotiques à base de céphalosporines et les bithérapies placent l'Amérique du Nord à la pointe de l'innovation thérapeutique. Les États-Unis et le Canada connaissent tous deux une augmentation du nombre de cas de gonorrhée résistante aux antimicrobiens.
Le marché américain des traitements contre la gonorrhée est en forte expansion, parallèlement à l'augmentation de l'incidence, avec 714 000 cas recensés en 2021. Selon les CDC, les financements liés aux IST sont renforcés dans le cadre des initiatives de préparation en santé publique et de recherche et développement. Le Congrès américain a alloué 1,39 milliard de dollars à la prévention des IST en 2023. Les tests d'amplification des acides nucléiques (TAAN) demeurent la méthode de référence pour le diagnostic et représentent une part importante des analyses de laboratoire. La PhRMA et les NIH se sont associés au gouvernement américain pour accélérer le développement de bithérapies antibiotiques et renforcer la surveillance de la résistance aux médicaments.
Aperçu du marché européen
L'Europe est le pays où le marché du traitement de la gonorrhée connaît la croissance la plus rapide et devrait représenter 24,3 % du marché mondial d'ici 2035. Ce marché est en pleine expansion, notamment en raison de la résistance croissante aux antibiotiques, de la prévalence accrue des infections sexuellement transmissibles et du renforcement des interventions de santé publique. Certaines innovations et tendances, comme l'adoption des plateformes de santé numérique et des ordonnances électroniques, améliorent l'accès au traitement pour les jeunes et les groupes à risque. Par ailleurs, l'implication croissante des autorités sanitaires nationales contribue à accroître la diffusion des traitements dans les hôpitaux, les cliniques et les pharmacies en ligne.
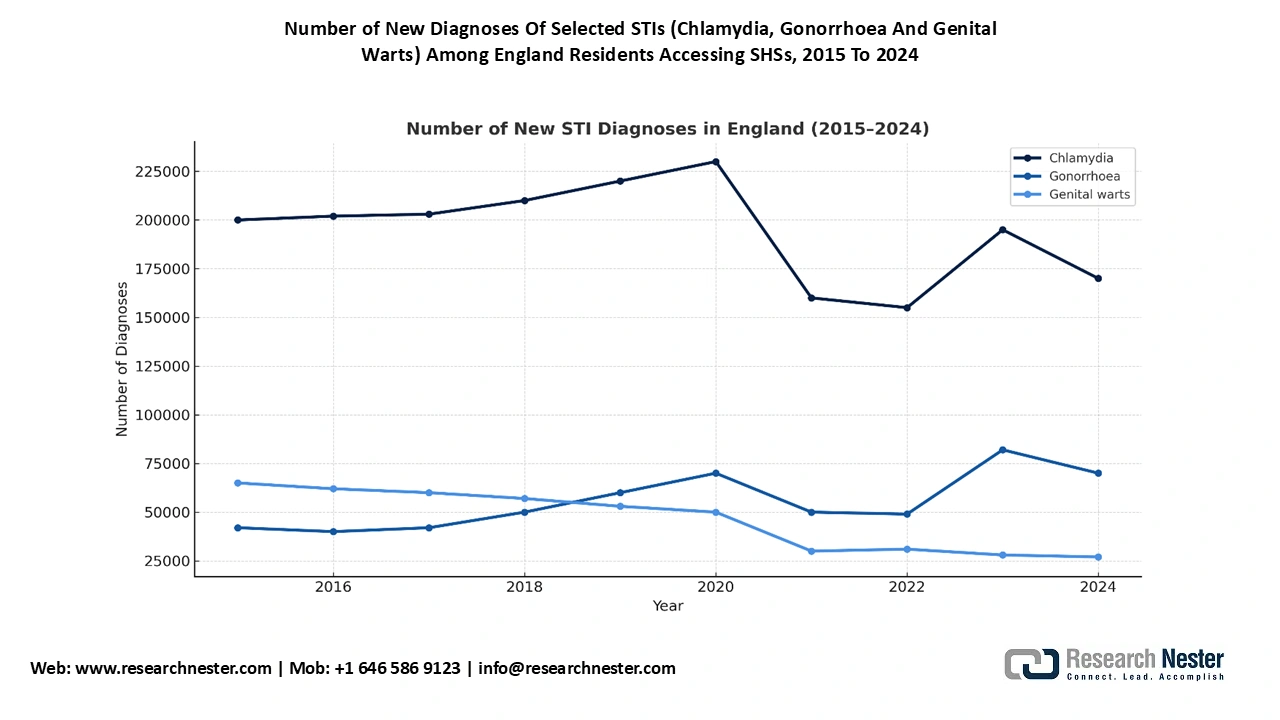
Source : Gouvernement du Royaume-Uni
Le Royaume-Uni devrait dominer le marché du traitement de la gonorrhée en 2035, avec 24,4 % des revenus. Selon l'Association des collectivités locales, en 2021, les services nationaux de santé sexuelle et reproductive (SSR) ont enregistré 4 002 827 consultations, soit une hausse de 15,7 % par rapport à 2020 et de 36 % depuis 2013. Par ailleurs, 1 949 940 dépistages des infections sexuellement transmissibles (IST), incluant les tests de diagnostic de la gonorrhée, de la chlamydiose, de la syphilis et du VIH, ont été réalisés par les SSR en 2021. Cela représente une augmentation de 18,7 % par rapport à 2020 et de 29 % par rapport à 2013. Le marché du traitement de la gonorrhée au Royaume-Uni est porté par l'amélioration continue des investissements publics et l'adoption rapide des services de santé numériques. Le Royaume-Uni reste le plus grand marché de traitement de la gonorrhée en Europe, en raison de la hausse de la prévalence des IST, notamment chez les personnes âgées de 16 à 30 ans.
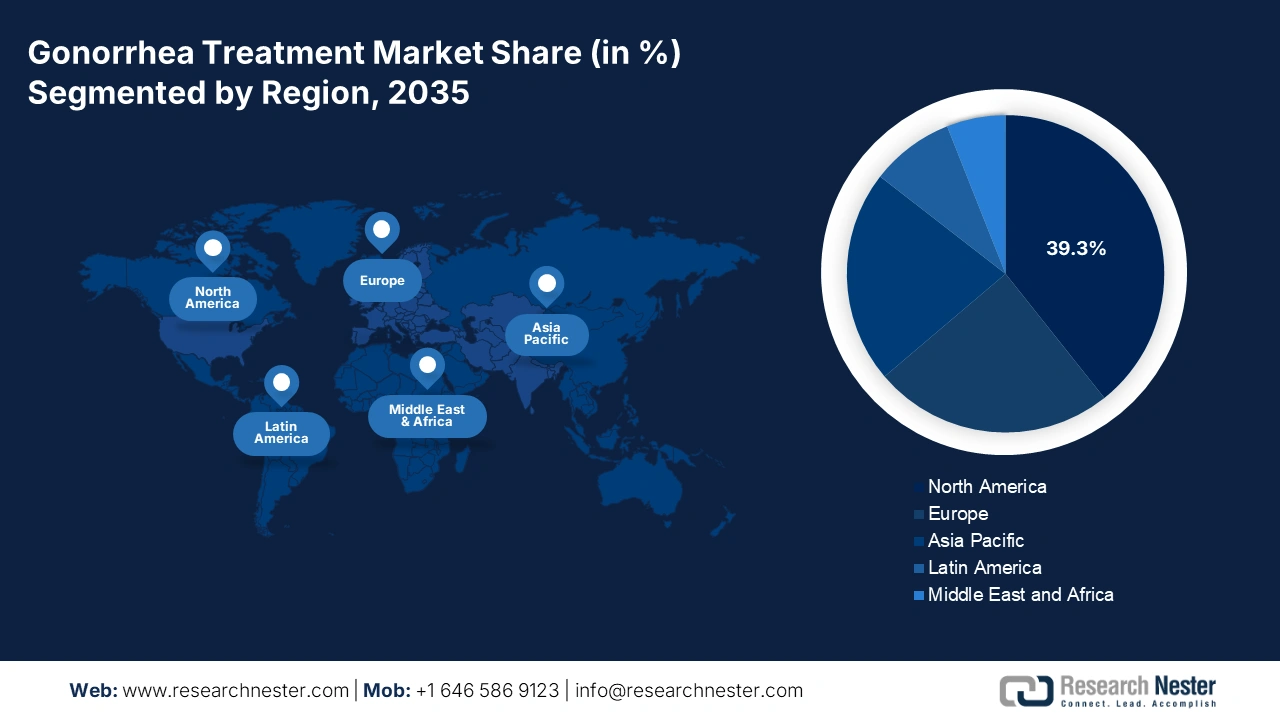
Principaux acteurs du marché du traitement de la gonorrhée :
- Présentation de l'entreprise
- Stratégie d'entreprise
- Principaux produits proposés
- Performance financière
- Indicateurs clés de performance
- Analyse des risques
- Développements récents
- Présence régionale
- Analyse SWOT
Le marché mondial des traitements contre la gonorrhée est extrêmement concurrentiel et de nombreux acteurs misent sur des antibiotiques innovants, des thérapies combinées et des outils de diagnostic performants. Des leaders comme Pfizer, GSK et Merck dominent ce marché en investissant dans le développement de bithérapies et en renforçant leurs capacités. Parallèlement, des fabricants indiens tels que Cipla et Sun Pharma s'imposent sur ce segment en facilitant l'accès aux traitements dans les régions en développement. Enfin, la compétitivité des principaux innovateurs crée de nombreuses opportunités tout au long de la chaîne de valeur.
Voici une liste des principaux acteurs opérant sur le marché du traitement de la gonorrhée :
Nom de l'entreprise (Pays) | Part de marché (2035, estimation) |
Pfizer Inc. (États-Unis) | 8,6% |
GlaxoSmithKline plc (Royaume-Uni) | 7,1% |
Merck & Co., Inc. (États-Unis) | 6,7% |
F. Hoffmann-La Roche Ltd. (Suisse) | 6,2% |
Astellas Pharma Inc. (Japon) | 5,3% |
Sanofi SA (France) | xx% |
Bayer AG (Allemagne) | xx% |
AbbVie Inc. (États-Unis) | xx% |
Takeda Pharmaceutical Co. Ltd. (Japon) | xx% |
Cipla Ltd. (Inde) | xx% |
Sun Pharmaceutical Industries Ltd. (Inde) | xx% |
Hikma Pharmaceuticals (Royaume-Uni/Jordanie) | xx% |
Laboratoires Dr. Reddy's Ltd. (Inde) | xx% |
Daiichi Sankyo Co., Ltd. (Japon) | xx% |
Lupin Ltd. (Inde) | xx% |
Celltrion Inc. (Corée du Sud) | xx% |
Biocon Ltd. (Inde) | xx% |
CSL Limited (Australie) | xx% |
Aurobindo Pharma (Inde) | xx% |
Pharmaniaga Berhad (Malaisie) | xx% |
Vous trouverez ci-dessous les domaines couverts par chaque entreprise sur le marché du traitement de la gonorrhée :
Développements récents
- En mai 2025, Roche a annoncé le lancement de son essai de phase 3 sur le zosurabalpin. Cet essai devrait débuter en 2026.
- En avril 2024, la FDA américaine a approuvé Zevtera pour injection (ceftobiprole médocaril sodium) ou ceftriaxone, répondant aux besoins des populations adultes et pédiatriques atteintes de pneumonie bactérienne communautaire (CARP).
- Report ID: 7808
- Published Date: Oct 03, 2025
- Report Format: PDF, PPT
- Découvrez un aperçu des principales tendances du marché et des insights
- Passez en revue des tableaux de données d’échantillon et des analyses par segment
- Découvrez la qualité de nos représentations visuelles de données
- Évaluez la structure de notre rapport et notre méthodologie de recherche
- Jetez un coup d’œil à l’analyse du paysage concurrentiel
- Comprenez comment les prévisions régionales sont présentées
- Évaluez la profondeur des profils d’entreprise et du benchmarking
- Visualisez comment des insights exploitables peuvent soutenir votre stratégie
Explorez des données et des analyses réelles
Questions fréquemment posées (FAQ)
Traitement de la gonorrhée Portée du rapport de marché
L’échantillon gratuit comprend la taille actuelle et historique du marché, les tendances de croissance, des graphiques et tableaux régionaux, des profils d’entreprises, des prévisions par segment, et plus encore.
Contactez notre expert




