遗传性血管性水肿治疗市场展望:
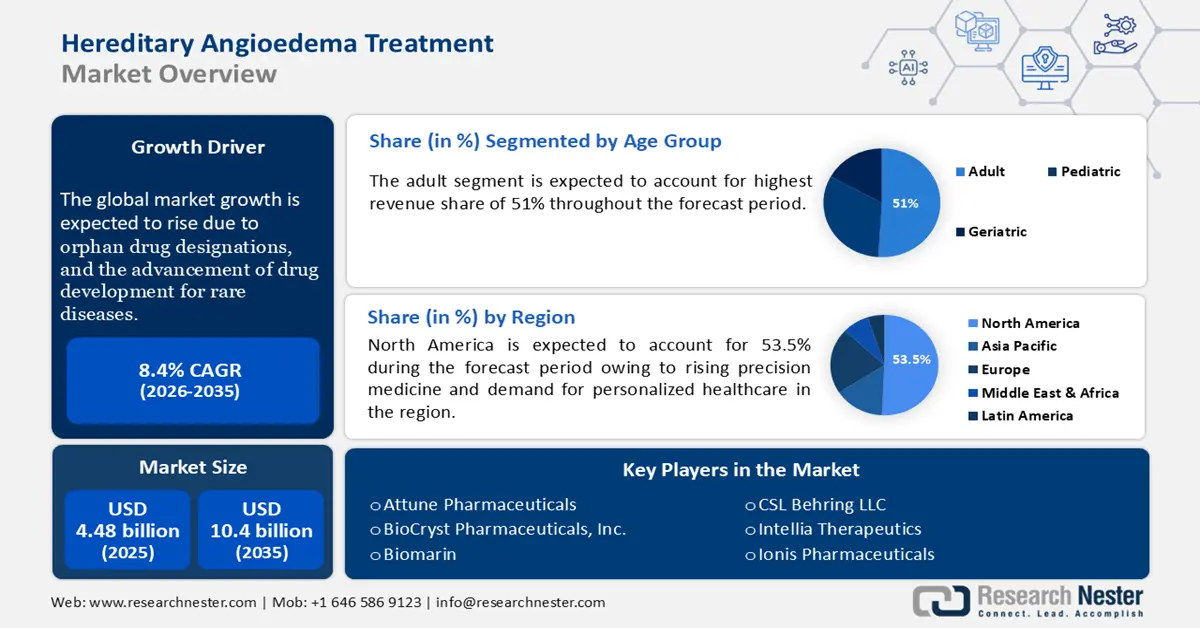
2025年遗传性血管性水肿治疗市场规模为44.8亿美元,预计到2035年将达到100.4亿美元,在预测期内(即2026年至2035年)的复合年增长率约为8.4%。2026年,遗传性血管性水肿治疗的行业规模估计为48.2亿美元。
遗传性血管性水肿治疗市场正在迅速扩张,这得益于治疗方案的进步、诊断水平的提高以及人们对该疾病认识的不断提高。此外,旨在降低血管性水肿(HAE)发作频率和严重程度的新型生物制剂、基因疗法和预防性治疗的日益普及也推动了市场的增长。根据罕见病顾问的数据,全球每5万人中就有1人患有遗传性血管性水肿。
患者权益团体的兴起、孤儿药认定以及罕见病药物研发的推动,正在推动遗传性血管性水肿治疗市场的扩张。市场参与者主要关注两方面:正在进行的临床试验旨在寻求长期治愈方案,并满足日益增长的治疗需求。例如,2024年2月,KalVista Pharmaceuticals, Inc. 宣布了其3期临床试验KONFIDENT的积极结果。KONFIDENT证明了sebetralstat作为HAE口服按需疗法在统计学和临床上均具有显著疗效。个性化医疗方法和基因组学研究的进步预计将进一步塑造市场的未来。
关键 遗传性血管性水肿治疗 市场洞察摘要:
区域亮点:
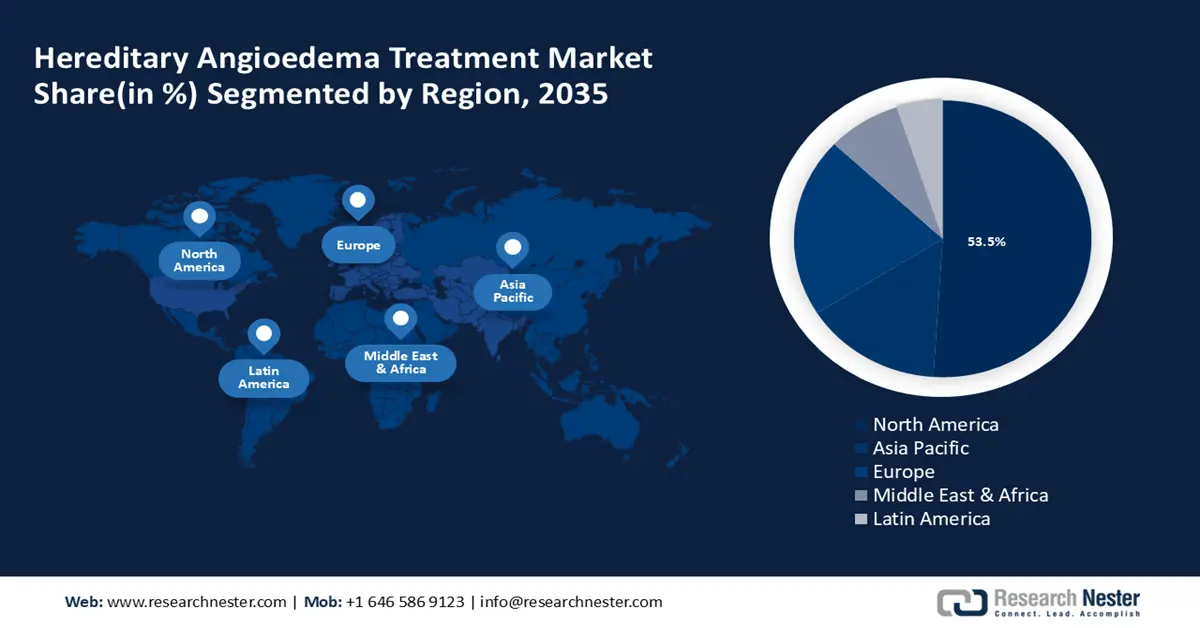
- 北美以 53.5% 的份额领先遗传性血管性水肿治疗市场,这得益于精准医疗和个性化医疗需求的增长,并将在 2026 年至 2035 年期间促进创新。
细分市场洞察:
- 预计医院药房细分市场将在 2026 年至 2035 年间经历显著增长,这得益于严重动脉血管性水肿 (HAE) 发作期间需要立即干预的专科护理需求。
- 预计到 2035 年,遗传性血管性水肿治疗市场的成人细分市场将占据 51% 以上的份额,这得益于发病率和严重程度的提高,从而增加了治疗需求。
主要增长趋势:
- 颅脑外伤病例增多
- 诊断技术和新药研发的进步
主要挑战:
- 对新型动脉栓塞 (HAE) 疗法的严格监管
- 治疗费用高昂
- 主要参与者:BioCryst Pharmaceuticals, Inc.、Biomarin、CSL Behring LLC。
全球 遗传性血管性水肿治疗 市场 预测与区域展望:
市场规模及增长预测:
- 2025 年市场规模: 44.8 亿美元
- 2026 年市场规模: 48.2 亿美元
- 预计市场规模: 2035 年将达到 100.4 亿美元
- 增长预测: 8.4% 复合年增长率 (2026-2035)
主要区域动态:
- 最大的地区:北美(到2035年占比53.5%)
- 增长最快的地区:欧洲
- 主要国家:美国、德国、日本、英国、法国
- 新兴国家:中国、印度、日本、韩国、新加坡
Last updated on : 28 August, 2025
遗传性血管性水肿治疗市场的增长动力和挑战:
增长动力
- 颅内动脉栓塞 (HAE) 病例不断增加:罕见病顾问 (Rare Disease Advisor) 于 2022 年 6 月发表的一篇文章指出,在美国,HAE 发作每年导致 15,000 至 30,000 例急诊入院。随着人们对该疾病认识的提高,越来越多的患者被诊断出来,从而对有效治疗的需求也随之增加。病例的增加也归因于对该疾病遗传因素的认识的加深。这有利于早期发现和干预,从而促进了旨在控制症状和预防发作的疗法市场的发展。预计不断增长的患者数量将增加对急性症状管理和预防措施的需求,以降低发作频率。
- 诊断技术和新药研发的进步:包括基因编辑、单克隆抗体和生物制剂在内的生物技术创新,催生了针对性更强的HAE治疗方案。这些进步使得治疗方案不仅能够缓解症状,还能预防发作。此外,药物配方的改进也使患者更容易获得治疗。2024年1月,Pharmavaris宣布,美国食品药品监督管理局(FDA)已解除对用于预防性治疗HAE发作的deucrictibant临床试验新药(IND)申请的临床搁置。随着新药的不断涌现和技术的进步,随着靶向性更强的治疗方案的出现,HAE市场有望迎来显著增长。
挑战
- 针对新型动脉血栓栓塞 (HAE) 疗法的严格监管:这对市场构成了重大挑战,因为新疗法的审批流程通常冗长复杂,需要进行大量临床试验以确保安全性和有效性。监管机构实施的严格标准可能会延迟新疗法的推出,从而限制 HAE 患者可获得的治疗选择。
- 治疗费用高昂:遗传性血管性水肿治疗市场面临的一大挑战是晚期血管性水肿(HAE)治疗费用的不断上涨。由于药物的特异性和目标患者群体较小,许多现有疗法价格高昂。这给患者和医疗保健系统带来了经济障碍,限制了有效治疗的可及性,尤其是在医疗资源有限的地区。
遗传性血管性水肿治疗市场规模和预测:
| 报告属性 | 详细信息 |
|---|---|
|
基准年 |
2025 |
|
预测期 |
2026-2035 |
|
复合年增长率 |
8.4% |
|
基准年市场规模(2025年) |
44.8亿美元 |
|
预测年度市场规模(2035 年) |
100.4亿美元 |
|
区域范围 |
|
遗传性血管性水肿治疗市场细分:
分销渠道(医院药房、药店和零售药房、网上药房)
按分销渠道划分,预测期内遗传性血管性水肿治疗市场的医院药房预计将以可观的复合年增长率增长。严重和急性血管性水肿发作的专科护理通常需要立即进行医疗干预并给予包括C1抑制剂在内的先进疗法。医院配备了处理这些紧急情况所需的必要资源,包括诊断工具和接受过罕见病管理培训的熟练医疗保健专业人员。血管性水肿患病率的上升增加了医院急诊和定期监测的就诊次数。
越来越多的临床试验和在医院环境中开展的新型疗法的开发也推动了该领域的增长。医院是基因疗法等创新疗法的中心,这些疗法最初是通过临床试验项目引入的。此外,预计医院采用更先进的治疗方案(例如精准治疗和个性化医疗)将显著改善患者的治疗效果。在预测期内,医院内专业化动脉栓塞(HAE)治疗中心的建设也可能推动该领域的增长。
年龄组(儿童、成人、老年人)
预计到2035年底,成人市场将占据遗传性血管性水肿治疗市场51%以上的份额。该市场增长的主要原因包括:HAE发病较晚或诊断延迟,成年期更容易准确识别症状。此外,成人发病频率更高、病情更严重,这增加了对预防性和急性治疗的需求。压力、荷尔蒙变化和工作压力等生活方式因素也会诱发HAE,进一步促进该市场的增长。
基于基因和症状特征的个性化医疗技术进步,定制化治疗方案能够确保成年患者获得更佳的疾病管理。此外,市场预计长期预防性治疗方案的开发和自我给药疗法的推广将得到更广泛的应用。这将使成年患者能够更独立地管理自身病情,预计将在预测期内进一步推动市场增长。
我们对市场的深入分析包括以下几个部分:
治疗类型 |
|
给药途径 |
|
年龄组 |
|
分销渠道 |
|

Vishnu Nair
全球业务发展主管根据您的需求定制此报告 — 联系我们的顾问,获取个性化见解和选项。
遗传性血管性水肿治疗市场区域分析:
北美市场分析
预计到2035年,北美产业将占据最大的收入份额,达到53.5%。该市场涵盖旨在治疗通过基因突变遗传疾病的疗法,包括基因疗法、酶替代疗法和基因编辑技术。精准医疗和个性化医疗的兴起进一步刺激了该地区对这些疗法的需求。此外,知名企业的加入及其研发和产品开发也显著推动了该地区市场的增长。例如,2024年3月,Astria Therapeutics宣布了评估STAR-0215的ALPHA-STAR 1b/2期临床试验的初步概念验证结果呈阳性。STAR-0215是一种血浆激肽释放酶单克隆抗体抑制剂,用于治疗遗传性血管性水肿(HAE)患者。
美国国家医学图书馆(National Library of Medicine)在美国医生中开展了一项网络调查。调查结果显示,2019年5月至2020年4月期间,美国约有1,230至1,331人患有HAE-nl-C1INH。由于2020年以来HAE病例数不断上升,美国市场正在经历显著增长,而这种罕见遗传病诊断水平的提高更是进一步推动了这一增长。市场上的知名企业正致力于开发新型生物制剂,以提供长期解决方案。优惠的报销政策和持续的临床研究也为市场提供了支撑。
随着加拿大诊断实践的改进和先进治疗手段的普及,HAE市场正在稳步增长。强大的医疗保健体系和政府对罕见病治疗的持续支持也推动了市场的发展。加拿大企业正在加大对先进设备开发的投资。2021年11月,BioCryst Pharmaceutical, Inc.、Royalty Pharma plc 和 OMERS Capital Markets 宣布为 BioCryst 新增 3.5 亿美元融资。新增资金旨在进一步推进 BCX9930 的研发,并支持 ORLADEYO 的全球上市。
欧洲市场统计
人们对罕见病的认识不断提高、诊断率不断提高,加上该地区知名企业不断开发新型疗法,这些因素正在稳步推动欧洲市场的发展。完善的医疗设施和监管框架鼓励开发和推广用于治疗包括 HAE 在内的罕见病的孤儿药。德国、意大利和法国是该地区市场增长的主要贡献者。知名企业也在该地区展示了许多进展。例如,2023 年 12 月,大冢制药株式会社 (Otsuka Pharmaceuticals Co., Inc.) 签署了一项许可协议,大冢获得了 Ionis HAE 候选药物 donidalorsen 在欧洲的独家营销权。包括欧洲药品管理局 (EMA) 和罕见病倡导团体在内的组织在促进 HAE 疗法的批准和报销方面发挥着至关重要的作用。
德国医疗保健体系促进了罕见疾病(包括遗传性血管性水肿 (HAE))的早期诊断和治疗。根据德国国家医学图书馆的数据,截至2024年1月,德国约有1700名HAE患者。德国的监管机构和医疗保险体系在确保患者获得这些先进治疗方案方面也发挥着重要作用。遗传性血管性水肿治疗市场中知名企业的涌现也显著推动了该市场的增长。
法国注重以患者为中心的医疗服务,并提供创新疗法,此外,其罕见病覆盖范围广泛,并得到公众支持。这些因素推动了该国罕见病市场的成功发展。法国国家罕见病计划等组织支持包括罕见病(HEA)在内的疾病的研究、诊断和患者护理。此外,法国拥有庞大的罕见病专科中心网络,确保患者获得适当的护理和管理。因此,预计未来几年法国罕见病市场将实现显著增长。
遗传性血管性水肿治疗市场的主要参与者:
- Attune制药公司
- 公司概况
- 商业策略
- 主要产品
- 财务表现
- 关键绩效指标
- 风险分析
- 近期发展
- 区域影响力
- SWOT分析
- BioCryst制药公司
- 比奥马林
- CSL贝林有限责任公司
- Intellia治疗公司
- 伊奥尼斯制药公司
- KalVista制药公司
- Pharming Healthcare, Inc.
- 法瓦里斯
遗传性血管性水肿治疗市场由几家关键公司主导,显著塑造了创新疗法的格局。这些公司专注于急性治疗和预防性治疗。2021年9月,Cycle Pharmaceuticals宣布推出SAJAZIR注射液,为遗传性血管性水肿患者提供新的治疗选择。该疗法已获得美国食品药品监督管理局(FDA)的批准。近年来,遗传性血管性水肿治疗市场的竞争愈演愈烈。各公司正寻求通过提高疗效、安全性和易用性来实现产品差异化。其中一些知名公司包括:
最新发展
- 2024 年 1 月, Ionis Pharmaceuticals, Inc.宣布 Donidalorsen 治疗遗传性血管性水肿患者的 3 期 OASIS-HAE 研究取得积极结果
- 2023年3月,Intellia Therapeutics公司获得FDA批准,提交NTLA-2002的新药临床试验(IND)申请。NTLA-2002是一种体内基因组编辑候选药物,旨在灭活目标基因,并在单剂量治疗后预防HAE发作。
- 2022 年 11 月, BioCryst Pharmaceuticals, Inc.获得以色列卫生部的营销授权,可口服每日一次的 ORLADEYO 来预防 HAE 发作。
- 2021 年 7 月, Orchard Therapeutics和 Pharming Group NV宣布建立战略合作,研究、开发、制造和商业化 OTL-105,用于治疗遗传性血管性水肿。
- Report ID: 6520
- Published Date: Aug 28, 2025
- Report Format: PDF, PPT
- 探索关键市场趋势和洞察的预览
- 查看样本数据表和细分分析
- 体验我们可视化数据呈现的质量
- 评估我们的报告结构和研究方法
- 一窥竞争格局分析
- 了解区域预测的呈现方式
- 评估公司概况与基准分析的深度
- 预览可执行洞察如何支持您的战略
探索真实数据和分析
常见问题 (FAQ)
遗传性血管性水肿治疗 市场报告范围
版权所有 © 2026 Research Nester。保留所有权利。




