Prospettive di mercato dell'amifampridina:
Il mercato dell'amifampridina è stato stimato in 162 milioni di USD nel 2025 e si prevede che raggiungerà i 349,7 milioni di USD entro la fine del 2035, con un CAGR dell'8% nel periodo di previsione, ovvero dal 2026 al 2035. Nel 2026, la dimensione del settore dell'amifampridina è stimata in 174,9 milioni di USD.

Il mercato globale dell'amifampridina sta attraversando trasformazioni significative a causa della sua crescente adozione nel trattamento della sindrome miastenica di Lambert-Eaton (LEMS) e dell'espansione delle approvazioni di farmaci orfani. La LEMS può essere tipicamente divisa in sottotipi autoimmuni (A-LEMS) e paraneoplastici (P-LEMS). Circa il 50% di tutti i casi di LEMS presenta una neoplasia maligna sottostante, in particolare il carcinoma polmonare a piccole cellule (SCLC). Nel contesto del carico di malattia, gli studi suggeriscono che la LEMS si verifica in circa il 3% dei pazienti con SCLC e, al contrario, circa il 40-70% degli individui a cui viene diagnosticata la LEMS presenta di conseguenza anche SCLC. Sebbene i tassi di incidenza e prevalenza della LEMS a livello mondiale siano incerti, uno studio basato sulla popolazione pubblicato da Frontiers nell'agosto 2025 ha fornito alcuni spunti. I Paesi Bassi hanno registrato una prevalenza di 2,3 per milione e un tasso di incidenza di 0,5, mentre gli Stati Uniti hanno riportato un tasso di prevalenza di 2,6 per milione. A livello globale, la prevalenza stimata della LEMS è di 2,8 per milione, il che la classifica come malattia rara.
Turchia: Riepilogo epidemiologico del pool di pazienti LEMS (2015-2024)
Parametro | Dati segnalati |
Casi confermati di LEMS (2015-2024) | 159 |
Popolazione nazionale (2024) | 85.664.944 |
Età media alla diagnosi | 60 anni (intervallo 16-88) |
Età media ± DS | 58,1 ± 14,9 anni |
Distribuzione del sesso | Donne: 55,3% (n = 88); Uomini: 44,7% (n = 71) |
Casi P-LEMS | 59,7% (n = 95) |
Casi A-LEMS | 40,3% (n = 64) |
Associazione SCLC (all'interno di P-LEMS) | 55,8% (n = 53) |
Incidenza annuale (2015-2024) | 0,09-0,30 per milione (0,27/milione nel 2024) |
Prevalenza complessiva (2024) | 1,11 per milione |
Prevalenza di A-LEMS (2024) | 0,60 per milione |
Prevalenza di P-LEMS (2024) | 0,51 per milione |
Mortalità | A-LEMS: 23,4%; P-LEMS: 58,9% |
Utilizzo di farmaci (prescrizione) | Piridostigmina: 65,4%; Amifampridina: 24,5% |
Distribuzione geografica | Più alto nel Mar Nero, nell'Egeo, nell'Anatolia centrale |
Fonte: Istituto statistico turco, Frontiers
Riepilogo della sperimentazione clinica
Studi clinici hanno dimostrato l'efficacia della 3,4-diaminopiridina (3,4-DAP) o amifampridina nel favorire la trasmissione neuromuscolare e la forza muscolare. Diversi studi hanno evidenziato miglioramenti nei punteggi dei pazienti rispetto al placebo. Ciò ha portato ad approvazioni normative a supporto da parte di enti governativi come la FDA e l'EMA statunitensi. L'amifampridina si è affermata come terapia gold standard per la LEMS, oltre agli studi in corso che esplorano formulazioni ottimizzate e applicazioni neuromuscolari più ampie. Il suo sviluppo rappresenta una pietra miliare significativa nella farmacoterapia delle malattie rare, offrendo una migliore funzionalità e qualità della vita ai pazienti con disturbi debilitanti della trasmissione neuromuscolare.
1. Amifampridina fosfato per il trattamento delle sindromi miasteniche congenite
Campo | Dettagli |
ID ClinicalTrials.gov | NCT02562066 |
Descrizione riassuntiva | Studio randomizzato, in doppio cieco, controllato, ambulatoriale, crossover a due periodi e due trattamenti per valutare l'efficacia e la sicurezza dell'amifampridina fosfato in pazienti (età ≥2) con determinati sottotipi genetici di CMS che hanno dimostrato un trattamento in aperto (amifampridina fosfato) o una storia di beneficio sostenuto. |
Stato di reclutamento | Completato |
Condizioni / Indicazione | Sindromi miasteniche congenite |
Intervento(i) | Farmaco: amifampridina fosfato (orale) - continuazione vs. placebo (in cieco durante i periodi di crossover) |
Fase | Fase 3 |
Tipo di studio | Interventistico |
Fascia d'età (idonea) | Minimo: 2 anni; Massimo: 70 anni |
Iscrizione / Dimensione del campione | Non fornito nell'estratto |
Requisito chiave di rodaggio | Fase di run-in del trattamento/aumento della dose del farmaco in aperto e senza cieco fino a 4 settimane, fino al raggiungimento di una dose/frequenza stabile per 7 giorni prima della randomizzazione. |
Obiettivo primario/endpoint (implicito) | Valutare l'efficacia e la sicurezza dell'amifampridina fosfato rispetto al placebo nella CMS. (Il testo esatto dell'endpoint primario non è fornito nell'estratto.) |
Criteri di esclusione | 1. Sottotipi di CMS: deficit di acetilcolinesterasi, sindrome del canale lento, deficit di LRP4, deficit di plectina. 2. Difetti della conduzione cardiaca all'ECG di screening. 3. Disturbo convulsivo. 4. Test di funzionalità epatica anormali durante lo screening. 5. Test di funzionalità renale anormali durante lo screening. 6. Valori elettrolitici anormali allo screening. 7. Gravidanza/allattamento o pianificazione di una gravidanza. 8. Qualsiasi infezione sistemica clinicamente significativa non trattata. 9. Trattamento con un altro farmaco/dispositivo/biologico sperimentale entro 30 giorni prima dello screening. 10. Qualsiasi altra condizione medica che potrebbe interferire o aumentare il rischio secondo l'investigatore. 11. Storia di allergia a sostanze contenenti piridina o agli eccipienti dello studio. |
Contatto principale / Posizione | Ospedale pediatrico di Boston |
Scarica / Data di registrazione | 2021-04-02 |
Fonte: Ospedale pediatrico di Boston
2. Amifampridina fosfato
Sezione | Dettagli |
Data NOC | 31 luglio 2020 |
Sponsor | KYE Pharmaceuticals Inc. |
Stato di approvazione di Health Canada | NOC |
Percorso di revisione di Health Canada | Revisione prioritaria |
Comparatore | Placebo (studi di astinenza) |
Obiettivo terapeutico | Miglioramento della qualità della vita correlata alla salute (HRQoL) e delle attività funzionali della vita quotidiana (ADL) |
Metodi di valutazione (secondo l'esperto clinico CADTH) | Risposta soggettiva del paziente; esame neurologico oggettivo; 3TUG (Triple Timed-Up-and-Go) o QMGS; studio elettrofisiologico (ampiezza CMAP pre/post contrazione volontaria massima). |
Studi fondamentali inclusi | 1. LMS-002 2. LMS-003 |
Progettazione dello studio | Studi di sospensione di fase III, multicentrici, randomizzati, in doppio cieco, controllati con placebo |
Scopo primario | Per valutare la sicurezza e l'efficacia dell'amifampridina fosfato nei pazienti adulti con LEMS |
Punti salienti dell'idoneità | Pazienti adulti con LEMS confermata; pazienti mai trattati con amifampridina hanno richiesto un miglioramento del QMGS ≥3 punti durante il run-in; tutti i pazienti hanno richiesto ≥91 giorni di precedente trattamento con amifampridina e ≥7 giorni di dosaggio stabile. |
Uso continuo | I pazienti responder dovrebbero proseguire la terapia per tutta la vita. I pazienti non responder interrompono la terapia in base a criteri combinati soggettivi e oggettivi (risposta del paziente, esame neurologico, 3TUG/QMGS, elettrofisiologia). |
Conclusione CADTH (implicita) | Il fosfato di amifampridina dimostra un'efficacia statisticamente significativa rispetto al placebo negli studi di sospensione del LEMS; i miglioramenti nei risultati funzionali e nei benefici riferiti dai pazienti supportano la rilevanza clinica; profilo di sicurezza gestibile. |
Fonte: NCBI, CADTH (Agenzia canadese per i farmaci e le tecnologie sanitarie) – Revisione clinica, 2024
Chiave Amifampridina Riepilogo delle Analisi di Mercato:
Punti salienti regionali:
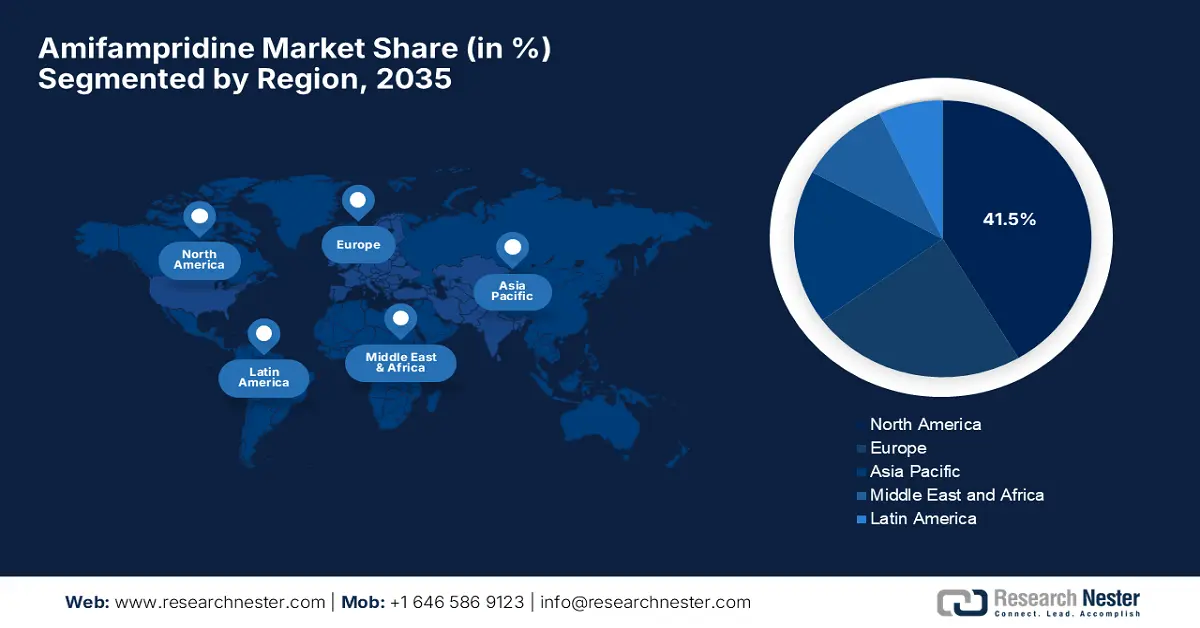
- Si stima che entro il 2035 il mercato nordamericano dell'amifampridina rappresenterà una quota di circa il 41,5%, trainato da una solida infrastruttura medica e da una crescente consapevolezza delle malattie neuromuscolari.
- Il mercato dell'Asia-Pacifico è destinato a registrare una crescita significativa nel periodo 2026-2035, grazie all'aumento dei casi di malattie neuromuscolari e al miglioramento dell'accesso alle cure.
Informazioni sui segmenti:
- Si prevede che entro il 2035 il segmento generico raggiungerà la quota più alta del mercato dell'amifampridina, pari al 75,4%, spinto dalla crescente domanda di soluzioni terapeutiche accessibili.
- Si prevede che il segmento della miastenia grave rappresenterà una quota redditizia nel periodo 2026-2035, a causa della crescente prevalenza di questa malattia curabile con amifampridina.
Principali tendenze di crescita:
- Concentrarsi sulla riduzione dei costi dei farmaci per renderli accessibili
- Crescenti investimenti nelle attività di ricerca
Sfide principali:
- Costi elevati del trattamento e ostacoli normativi
Attori principali: Catalyst Pharmaceuticals (Stati Uniti), BioMarin Pharmaceutical (Stati Uniti), Jacobus Pharmaceutical (Stati Uniti), Medunik Canada (Canada), ORSPEC Pharma (Australia), Shilpa Medicare (India), SERB SA (Francia), Tiefenbacher Pharmaceuticals (Germania), Chiracon GmbH (Germania), Zydus Cadila (India), Apotex (Canada), Sandoz (Svizzera), Teva Pharmaceuticals (Israele).
Globale Amifampridina Mercato Previsioni e prospettive regionali:
Proiezioni di crescita e dimensioni del mercato:
- Dimensioni del mercato nel 2025: 162 milioni di USD
- Dimensioni del mercato nel 2026: 174,9 milioni di USD
- Dimensione prevista del mercato: 349,7 milioni di USD entro il 2035
- Previsioni di crescita: CAGR 8% (2026-2035)
Dinamiche regionali chiave:
- Regione più grande: Nord America (quota del 41,5% entro il 2035)
- Regione in più rapida crescita: Asia-Pacifico
- Paesi dominanti: Stati Uniti, Germania, Francia, Giappone, Cina
- Paesi emergenti: India, Malesia, Corea del Sud, Brasile, Messico
Last updated on : 3 November, 2025
Mercato dell'amifampridina: fattori di crescita e sfide
Fattori di crescita
- Concentrarsi sulla riduzione dei costi dei farmaci per renderli accessibili: l'analisi dei prezzi condotta dall'NCBI nel luglio 2022 indica che il trattamento con Firdapse costa circa 51.993 USD/anno per paziente in Canada. CADTH prevede che un'ulteriore riduzione dei costi sia fondamentale per promuovere la penetrazione del mercato e raggiungere la soglia di disponibilità a pagare di 50.000 USD. Secondo la revisione clinica CADTH del 2020, il prezzo presentato per l'amifampridina fosfato era di 21,90 USD per compressa da 10 mg, ovvero inferiore del 20% rispetto al costo pubblicamente disponibile dell'amifampridina base. Alla dose giornaliera tipica di 61,5 mg, il trattamento con amifampridina fosfato e amifampridina base costa rispettivamente 51.993 USD e 65.051 USD per paziente all'anno. Il risparmio annuo sul farmaco con amifampridina fosfato è di 13.058 USD per paziente, escluse le spese di dispensazione e i ricarichi.
Riepilogo dei risultati della valutazione economica dello sponsor (KYE Pharmaceuticals Inc.)
Farmaco | Costo totale dei farmaci ($) | Costi incrementali dei farmaci ($) | Costi totali ($) | Costi incrementali ($) |
Amifampridina fosfato | 51.993 | Riferimento | 55.220 | Riferimento |
Amifampridina | 65.051 | –13.058 | 69.062 | –13.841 |
Fonte: CADTH Clinical Review
- Crescenti investimenti in attività di ricerca: un altro importante motore per il mercato dell'amifampridina è l'aumento degli investimenti in iniziative di ricerca e sviluppo. A questo proposito, il settore biofarmaceutico basato sulla ricerca ha speso circa 198 miliardi di dollari a livello globale in R&S nel 2020. I dati del rapporto 2022 dell'International Federation of Pharmaceutical Manufacturers & Associations mostrano che gli effetti combinati indiretti, diretti e indotti del contributo cumulativo del settore al PIL globale ammontano a 1.838 miliardi di dollari. Rispetto a tutti gli altri settori ad alta tecnologia, la spesa annuale dell'industria biofarmaceutica è circa 8,1 volte superiore a quella dell'industria aerospaziale e della difesa, 7,2 volte superiore a quella del segmento chimico e 1,2 volte superiore a quella del settore software e dei servizi informatici.
Spesa per la ricerca e sviluppo biofarmaceutica
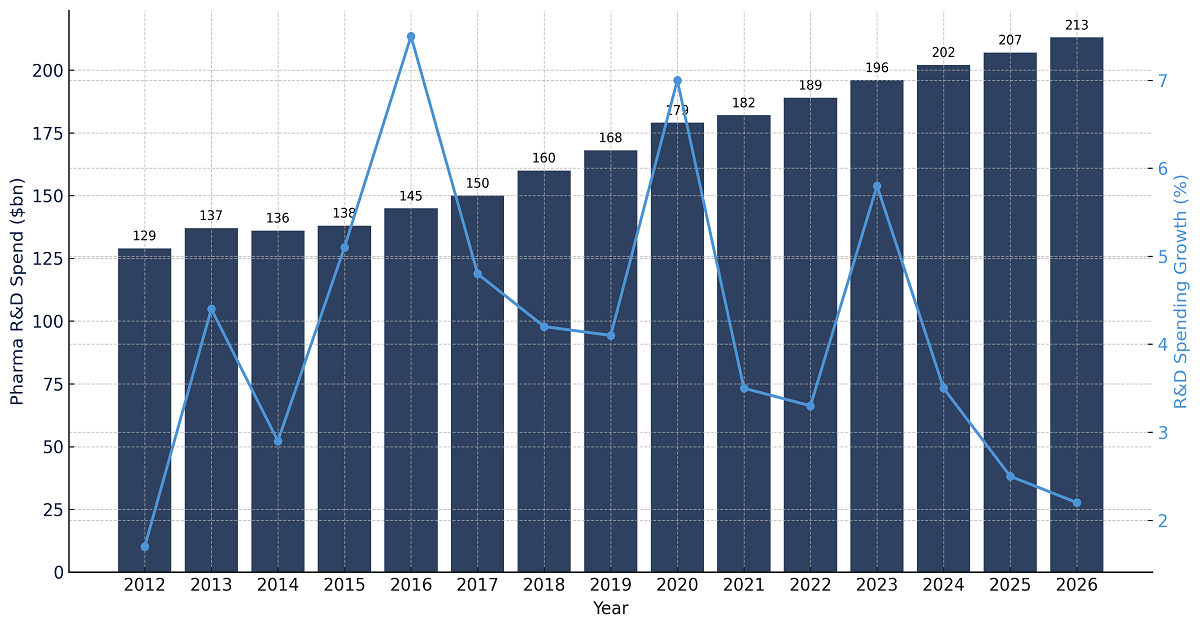
Fonte: IFPMA
Sfide
- Costi di trattamento elevati e ostacoli normativi: questo rappresenta uno degli ostacoli più significativi all'ingresso del mercato dell'amifampridina in quasi tutti i Paesi. Gli elevati costi di trattamento associati alle procedure di trattamento avanzate non sono accessibili per le persone provenienti da regioni sensibili al prezzo. I vincoli di bilancio rappresentano un ostacolo importante alla penetrazione del mercato in tutti i Paesi. Oltre all'esistenza di normative rigorose che garantiscono la sicurezza terapeutica, queste possono rappresentare un ostacolo al raggiungimento di una base di consumatori sostanziale da parte del mercato dell'amifampridina. Le sfide normative si traducono in ritardi nell'ingresso sul mercato, spesso riscontrati in regioni chiave come Giappone e Canada.
Dimensioni e previsioni del mercato dell'amifampridina:
| Attribut du rapport | Détails |
|---|---|
|
Anno base |
2025 |
|
Anno di previsione |
2026-2035 |
|
CAGR |
8% |
|
Dimensione del mercato dell'anno base (2025) |
162 milioni di dollari |
|
Dimensione del mercato prevista per l'anno (2035) |
349,7 milioni di dollari |
|
Ambito regionale |
|
Segmentazione del mercato dell'amifampridina:
Analisi del segmento di tipo
Si prevede che il segmento dei farmaci generici raggiungerà la quota di mercato più elevata, pari al 75,4%, entro la fine del 2035. Il predominio del segmento è attribuibile alla crescente domanda di soluzioni terapeutiche accessibili in tutti i paesi del mondo. I farmaci generici costituiscono la base di terapie economicamente vantaggiose, rendendo i trattamenti accessibili a una base di consumatori più ampia e rappresentando un'alternativa ideale ai farmaci di marca. Ad esempio, i Centers for Medicare & Medicaid Services hanno avviato programmi per incoraggiare l'uso di farmaci generici sia per i pazienti che per gli operatori sanitari, riducendo così la spesa medica. In questo modo, si è favorita la crescita del segmento.
Analisi del segmento applicativo
Si prevede che il segmento della miastenia grave rappresenterà una quota redditizia del mercato dell'amifampridina durante il periodo di previsione. La crescita del segmento è attribuibile all'aumento dei casi di questa patologia, potenzialmente trattabile con farmaci a base di amifampridina grazie alla loro maggiore efficacia. Inoltre, l'amifampridina è considerata altamente efficace nel migliorare gli esiti clinici dei pazienti riducendo i ricoveri ospedalieri, il che ne ha favorito l'ampia diffusione in diversi mercati a livello globale.
La nostra analisi approfondita del mercato include i seguenti segmenti:
Segmento | Sottosegmenti |
Tipo |
|
Applicazione |
|
Utente finale |
|
Dati demografici dei pazienti |
|

Vishnu Nair
Responsabile dello sviluppo commerciale globalePersonalizza questo rapporto in base alle tue esigenze — contatta il nostro consulente per approfondimenti e opzioni personalizzate.
Mercato dell'amifampridina - Analisi regionale
Approfondimenti sul mercato nordamericano
Si stima che il mercato nordamericano rappresenterà una quota di circa il 41,5% entro la fine del 2035. La crescita della regione è attribuibile alla solida infrastruttura medica, alla crescente consapevolezza sulle malattie neuromuscolari e a quadri normativi altamente responsabili. Oltre a ciò, la regione beneficia di ingenti investimenti da parte di organizzazioni sanitarie pubbliche e private per le malattie rare. Ospita un numero enorme di strutture neurologiche che facilitano la diagnosi precoce, promuovendo così soluzioni affidabili per i pazienti con bisogni medici insoddisfatti.
Gli Stati Uniti dominano il mercato nordamericano dell'amifampridina, grazie anche agli investimenti medici effettuati da enti sanitari pubblici per affrontare le malattie neuromuscolari rare. Ad esempio, i Centers for Medicare & Medicaid Services (CMS) hanno aumentato significativamente la spesa sanitaria per i trattamenti neuromuscolari. Inoltre, hanno anche dichiarato che la copertura per le terapie per malattie rare a base di amifampridina è stata ampliata per migliorare l'accesso dei pazienti. Infine, il National Institute of Health ha stanziato finanziamenti significativi per le attività di ricerca, a dimostrazione della forza del mercato. La tabella seguente mostra la spesa complessiva per la ricerca biofarmaceutica, inclusa l'amifampridina, nel 2020.
Spese di ricerca e sviluppo negli Stati Uniti, 2020
Funzione | Dollari (milioni di USD) | Condividere (%) |
Pre-umano / Pre-clinico | 13.604,0 | 14,9% |
Fase I | 6.968,3 | 7,6% |
Fase II | 8.429,4 | 9,3% |
Fase III | 24.773,1 | 27,2% |
Approvazione | 3.932,5 | 4,3% |
Fase IV | 10.512,4 | 11,5% |
Non categorizzato | 22.906,6 | 25,1% |
Ricerca e sviluppo totale | 91.126,3 | 100,0% |
Fonte: IFPMA
In Canada , l'amifampridina offre grandi opportunità, alimentate dall'ampia base di consumatori e dalle iniziative di finanziamento sostenute dal governo. La spesa canadese per farmaci generici e biosimilari è stata di 27,4 miliardi di dollari e si stima che raggiungerà i 32-36 miliardi di dollari entro la fine del 2026, con un CAGR del 3-6%, a dimostrazione dell'impatto economico del settore. Inoltre, i ministeri della salute provinciali, come quelli dell'Ontario e della British Columbia, hanno incrementato i loro investimenti, con conseguenti benefici annuali per i pazienti LEMS. Si prevede quindi che questi fattori stimoleranno il mercato nazionale, dimostrando opportunità di crescita redditizie entro il 2035.
Approfondimenti sul mercato APAC
Il mercato dell'Asia-Pacifico è destinato a registrare una crescita significativa durante il periodo di previsione, grazie all'aumento dei casi di malattie neuromuscolari, al loro accesso alle cure e agli ingenti investimenti sanitari da parte dei governi della regione. Inoltre, la crescita nella regione è soggetta alla tendenza allo sviluppo di paesi come Giappone, Cina, India, Malesia e Corea del Sud. Questi fattori contribuiscono al dinamico panorama del mercato del paese, con l'obiettivo di migliorare i risultati per i pazienti, incrementando così l'espansione del settore.
Il mercato indiano sta aprendo notevoli opportunità di crescita, trainate dalla crescente domanda di farmaci a base di amifampridina nel Paese. Ad esempio, nel 2023, la spesa medica del Paese ha raggiunto il 2,1% del PIL, con una quota considerevole destinata al sistema sanitario e alle iniziative terapeutiche. L'India ha assistito a un notevole aumento della spesa per le malattie rare, a causa del divario di mercato tra domanda e offerta di trattamenti. In India, si contano circa 8000 malattie rare e il 5% di esse ha trattamenti disponibili, colpendo così quasi un quinto della popolazione.
Il mercato cinese dell'amifampridina sta guadagnando un'enorme visibilità grazie al forte sostegno degli organi di governo del Paese. Fattori come le politiche amministrative favorevoli stanno favorendo un ambiente imprenditoriale positivo per gli operatori nazionali. La spesa pubblica per le malattie rare in Cina è aumentata significativamente negli ultimi cinque anni, grazie alla crescente consapevolezza di dover affrontare queste complesse patologie. Inoltre, la Cina è il principale esportatore di composti di anime, utilizzati principalmente per la produzione di amifampridina. Il valore delle esportazioni di composti di anime, secondo l'OEC, è stato stimato a 2,57 miliardi di dollari nel 2023 e il surplus commerciale è stato di 1,83 miliardi di dollari, a dimostrazione del predominio della Cina nella produzione e nelle spedizioni globali di prodotti di mercato.
Approfondimenti sul mercato europeo
Nel periodo di previsione, si prevede che il mercato europeo dell'amifampridina mostrerà opportunità di crescita redditizie grazie alla tendenza allo sviluppo di paesi come Germania e Francia, che rappresentano le quote di fatturato più elevate.
Il mercato tedesco è fortemente supportato da misure terapeutiche innovative e politiche di rimborso che mirano a posizionare il Paese come leader chiave in Europa. Inoltre, l'adozione di trattamenti avanzati e la ricerca medica contribuiscono alla crescita del business nella regione.
In Francia , il mercato è destinato a una crescita significativa, grazie al suo impegno nel fornire servizi sanitari eccellenti e un migliore accesso ai pazienti. Inoltre, il mercato riceve il massimo sostegno dal governo nel trattamento delle malattie rare e la copertura del rimborso consente di abituarsi all'uso intensivo del farmaco terapeutico. A ciò si aggiunge il contributo delle aziende farmaceutiche nazionali nel migliorare lo sviluppo e il trattamento associati al prodotto.
Principali attori del mercato dell'amifampridina:
- Catalyst Pharmaceuticals (Stati Uniti)
- Panoramica aziendale
- Strategia aziendale
- Offerte di prodotti chiave
- Performance finanziaria
- Indicatori chiave di prestazione
- Analisi del rischio
- Sviluppo recente
- Presenza regionale
- Analisi SWOT
- BioMarin Pharmaceutical (Stati Uniti)
- Jacobus Pharmaceutical (Stati Uniti)
- Medunik Canada (Canada)
- ORSPEC Pharma (Australia)
- Shilpa Medicare (India)
- SERB SA (Francia)
- Tiefenbacher Pharmaceuticals (Germania)
- Chiracon GmbH (Germania)
- Zydus Cadila (India)
- Apotex (Canada)
- Sandoz (Svizzera)
- Teva Pharmaceuticals (Israele)
- Catalyst Pharmaceuticals, Inc.: è un'azienda biofarmaceutica in fase commerciale con sede a Coral Gables, in Florida. L'azienda si concentra sulla concessione di licenze, sullo sviluppo e sulla commercializzazione di trattamenti per malattie rare. Il suo prodotto di punta è FIRDAPSE, l'unico trattamento basato sull'evidenza scientifica e approvato dalla FDA per i pazienti adulti affetti da LEMS. Catalyst Pharmaceuticals. L'azienda ha lanciato il prodotto commercialmente nel gennaio 2019, dopo l'approvazione della FDA nel novembre 2018.
- BioMarin Pharmaceutical Inc. è un'azienda biotecnologica statunitense con sede a San Rafael, in California, specializzata in trattamenti per malattie rare e orfane. BioMarin sviluppa, acquisisce e commercializza terapie per patologie gravi o rare. La sua pipeline include terapie enzimatiche sostitutive, farmaci orfani a piccole molecole e farmaci neuromuscolari. La sua strategia pone l'accento sugli incentivi normativi (designazioni di farmaci orfani, periodi di esclusività) e sulla distribuzione globale per indicazioni relative a malattie rare.
- Jacobus Pharmaceutical Company, Inc. è un'azienda farmaceutica statunitense privata con sede a Princeton/Plainsboro, nel New Jersey. È specializzata nello sviluppo e nella produzione di farmaci per malattie rare, spesso basati su terapie a piccole molecole. Jacobus è nota per il suo ruolo nella produzione e fornitura di amifampridina (nota anche come 3,4-diaminopiridina o 3,4-DAP) con il marchio Ruzurgi, in particolare per i pazienti pediatrici (6-16 anni) affetti da sindrome miastenica di Lambert-Eaton (LEMS).
- Médunik Canada è stata fondata nel dicembre 2009 ed è una sussidiaria del Duchesnay Pharmaceutical Group (DPG). La sua missione è migliorare la salute e la qualità della vita dei canadesi affetti da malattie rare, collaborando con aziende internazionali per portare i farmaci orfani in Canada. Médunik Canada ha sede in Canada (Québec) e fa parte della rete DPG.
- Orspec Pharma si descrive come un'azienda farmaceutica boutique focalizzata sull'accesso ai farmaci per pazienti con esigenze rare o specifiche. L'azienda opera nella regione Asia-Pacifico, concentrandosi sulla fornitura di farmaci a pazienti designati, sulla registrazione di farmaci orfani e sui programmi di accesso anticipato. L'entità principale sembra avere sede in Australia (West Gosford, Nuovo Galles del Sud) e opera nei mercati dell'area Asia-Pacifico.
Ecco un elenco dei principali attori che operano nel mercato globale:
Le aziende coinvolte nel mercato dell'amifampridina stanno focalizzando l'attenzione su diverse attività strategiche per rafforzare la propria presenza sul mercato globale. Aziende come Catalyst Pharmaceuticals e BioMarin Pharmaceutical hanno ottenuto un'ottima visibilità grazie all'innovazione e alla commercializzazione di Firdapse. Inoltre, Medunik Canada e Jacobus Pharmaceutical hanno migliorato l'accesso dei pazienti a Ruzurgi, un farmaco indicato per la popolazione pediatrica. Inoltre, le aziende stanno dando priorità al portafoglio prodotti, al finanziamento di iniziative e incoraggiando una sana competizione tra i vari attori.
Sviluppi recenti
- Nell'agosto 2025, Catalyst Pharmaceuticals, Inc. ha annunciato che la Società e il suo licenziatario SERB SA hanno firmato un accordo transattivo con Lupin Pharmaceuticals, Inc. e Lupin Ltd. che risolve il contenzioso brevettuale avviato da Catalyst e SERB in risposta alla domanda abbreviata di nuovo farmaco (ANDA) di Lupin per ottenere l'approvazione per il lancio di una versione generica delle compresse da 10 mg di FIRDAPSE.
- Nel gennaio 2025, Tiefenbacher Pharmaceuticals ha annunciato il lancio di Amifampridina in Europa. Questo farmaco è considerato un farmaco generico per la sindrome miastenica di Lambert-Eaton in tutta Europa, consolidando la sua presenza sul mercato.
- Report ID: 7694
- Published Date: Nov 03, 2025
- Report Format: PDF, PPT
- Esplora un’anteprima delle principali tendenze di mercato e degli approfondimenti
- Rivedi tabelle di dati campione e suddivisioni per segmento
- Vivi la qualità delle nostre rappresentazioni visive dei dati
- Valuta la struttura del nostro rapporto e la metodologia di ricerca
- Dai uno sguardo all’analisi del panorama competitivo
- Comprendi come vengono presentate le previsioni regionali
- Valuta la profondità del profilo aziendale e del benchmarking
- Anteprima di come gli insight attuabili possano supportare la vostra strategia
Esplora dati e analisi reali
Domande frequenti (FAQ)
Amifampridina Ambito del rapporto di mercato
Il campione gratuito include le dimensioni attuali e storiche del mercato, le tendenze di crescita, grafici e tabelle regionali, profili aziendali, previsioni per segmento e altro ancora.
Contatta il nostro esperto
Copyright © 2026 Research Nester. Tutti i diritti riservati.




