Perspectives du marché des logiciels de mise en correspondance des essais cliniques :
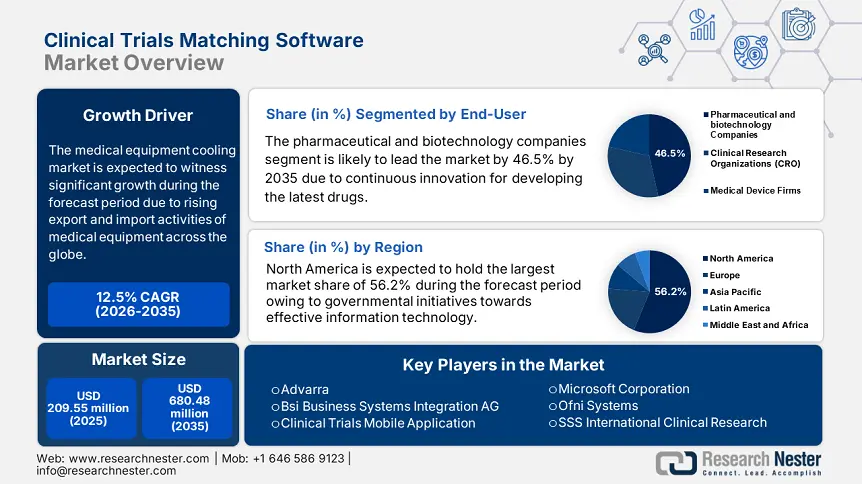
Le marché des logiciels de mise en correspondance des essais cliniques était évalué à 209,55 millions USD en 2025 et devrait atteindre 680,48 millions USD d'ici 2035, avec un taux de croissance annuel composé (TCAC) d'environ 12,5 % sur la période de prévision, soit entre 2026 et 2035. En 2026, le marché des logiciels de mise en correspondance des essais cliniques est estimé à 233,12 millions USD.
L'implémentation d'outils logiciels automatisés dans les essais cliniques garantit une méthode efficace pour identifier rapidement les patients potentiellement éligibles, ce qui stimule fortement l'essor du marché des logiciels de mise en correspondance des essais cliniques. Selon un article publié par la NLM en février 2023, un essai clinique se compose de différentes phases : la phase 0 (exploratoire), les phases Ia, Ib et Ic (essais non thérapeutiques), les phases II, IIa et IIb (essais exploratoires), la phase III (essai de confirmation thérapeutique) et la phase IV (étude post-approbation). Ainsi, la combinaison de toutes ces phases et l'intégration d'outils logiciels innovants sont suffisamment efficaces pour favoriser le développement du marché.
Le marché des logiciels de mise en correspondance des essais cliniques est en plein essor grâce à l'utilisation de technologies et de machines de traitement permettant d'évaluer la probabilité des études, de simplifier le recrutement et la maintenance des participants, de permettre l'inclusion de populations variées, de rationaliser la collecte et la gestion des données. De ce fait, l'utilisation d'ordinateurs et d'outils dans les essais cliniques est devenue monnaie courante, ce qui stimule leur demande croissante. Selon le rapport 2023 de l'OEC, la valeur du commerce mondial d'ordinateurs s'élevait à 323 milliards de dollars, la Chine étant le premier exportateur avec 158 milliards de dollars et les États-Unis le premier importateur avec 93,2 milliards de dollars.
De plus, l'utilisation d'outils dans les essais cliniques est utile pour une gestion efficace des opérations, des données et de la communication des études tout au long du cycle de vie, contribuant ainsi au développement du marché des logiciels de mise en correspondance des essais cliniques. De plus, ces outils facilitent l'évolution des pratiques et peuvent inclure des stratégies de mise en œuvre des lignes directrices, l'élaboration des politiques et la fourniture de supports d'audit de qualité. Selon le rapport 2023 de l'OEC, le commerce international d'ensembles d'outils est évalué à 1,29 milliard de dollars américains, la Chine étant le premier exportateur avec 606 millions de dollars américains et l'Allemagne le premier importateur avec 114 millions de dollars américains, ce qui a un impact positif sur la croissance du marché.
Comparaison des exportations et importations d'ordinateurs et d'ensembles d'outils
|
Pays |
Ordinateurs |
Ensembles d'outils |
||
|
Exporter |
Importer |
Exporter |
Importer |
|
|
Mexique |
29,5 milliards USD |
- |
- |
- |
|
Taipei |
27,1 milliards USD |
- |
158,0 millions USD |
- |
|
Vietnam |
15,9 milliards USD |
- |
- |
- |
|
États-Unis |
15,3 milliards USD |
93,2 milliards USD |
59,6 millions USD |
82,4 millions USD |
|
Allemagne |
- |
20,4 milliards USD |
USD 147,0 millions |
114,0 millions USD |
|
Hong Kong |
- |
15,5 milliards USD |
- |
- |
|
Pays-Bas |
- |
14,3 milliards USD |
29,3 millions USD |
68,4 millions USD |
|
Royaume-Uni |
- |
13,0 milliards USD |
- |
- |
|
Russie |
- |
- |
- |
114,0 millions USD |
|
France |
- |
- |
- |
93,7 millions USD |
Source : OEC 2023
Clé Logiciel de mise en correspondance des essais cliniques Résumé des informations sur le marché:
Points forts régionaux :
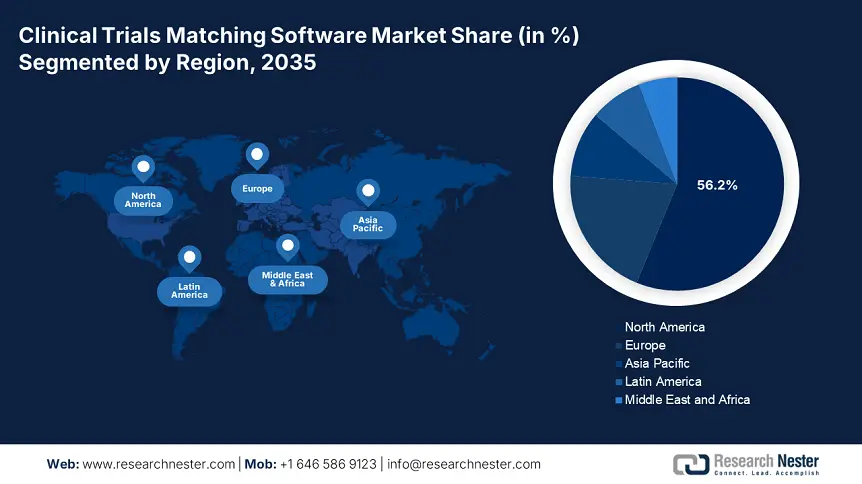
- L'Amérique du Nord détient 56,20 % du marché des logiciels de mise en correspondance des essais cliniques, grâce à l'acceptation des systèmes de mise en correspondance des essais de médicaments, aux stratégies gouvernementales et aux initiatives des NIH, ce qui garantit une forte croissance d'ici 2035.
- Le marché des logiciels de mise en correspondance des essais cliniques en Asie-Pacifique devrait connaître sa plus forte croissance d'ici 2035, grâce à la disponibilité d'un grand nombre de patients et à l'augmentation des projets informatiques dans le secteur de la santé.
Analyses sectorielles :
- Le secteur des sociétés pharmaceutiques et biotechnologiques devrait détenir plus de 46,5 % de parts de marché d'ici 2035, grâce au grand nombre d'essais cliniques nécessaires au lancement d'un produit.
- Le secteur des logiciels devrait connaître une croissance substantielle entre 2026 et 2035, grâce à l'utilisation et à l'adoption accrues des essais cliniques, à la mise en œuvre de la recherche et du développement, et aux généreuses contributions des organisations médicales.
Principales tendances de croissance :
- Intensification des activités d'essais cliniques
- Numérisation de la recherche
Défis majeurs :
- Logiciel coûteux
- Formation et adaptation insuffisantes
- Acteurs clés : Advarra, Antidote Technologies, Inc., IBM Clinical Development, application mobile d'essais cliniques.
Mondial Logiciel de mise en correspondance des essais cliniques Marché Prévisions et perspectives régionales:
Taille du marché et projections de croissance :
- Taille du marché 2025 : 209,55 millions USD
- Taille du marché 2026 : 233,12 millions USD
- Taille du marché projetée : 680,48 millions USD d'ici 2035
- Prévisions de croissance : TCAC de 12,5 % (2026-2035)
Dynamiques régionales clés :
- La plus grande région : Amérique du Nord (part de 56,2 % d'ici 2035)
- Région à la croissance la plus rapide : Asie-Pacifique
- Pays dominants : États-Unis, Allemagne, Japon, Royaume-Uni, France
- Pays émergents : Chine, Inde, Brésil, Russie, Mexique
Last updated on : 26 August, 2025
Moteurs de croissance et défis du marché des logiciels de mise en correspondance des essais cliniques :
Moteurs de croissance
- Augmentation des activités d'essais cliniques : Le marché des logiciels de mise en correspondance des essais cliniques devrait connaître une forte croissance grâce à l'amélioration des essais cliniques à l'échelle internationale. Selon le rapport de l'OMS de décembre 2024, les États-Unis comptent 186 497 essais supplémentaires, suivis de la Chine (135 747), de l'Inde (74 031), du Japon (65 167), de l'Allemagne (54 902), et bien d'autres encore. Cette augmentation est due à l'essor des technologies de santé avancées et à la demande croissante de médicaments innovants et hautement efficaces, qui amplifient considérablement le développement et l'évolution du marché.
- Numérisation de la recherche : L'intégration de technologies sophistiquées telles que la saisie électronique des données (SED) et les systèmes de gestion des essais cliniques accroît la demande mondiale de logiciels de mise en correspondance des essais cliniques. Selon un article publié dans les Actes de la Mayo Clinic en octobre 2023, 94 % des hôpitaux américains utilisaient déjà un dossier médical électronique (DME) pour prodiguer des soins cliniques, et 45 % de la population régionale totale utilisait un dossier médical électronique. Le DME a été initialement conçu comme un outil de soins centrés sur le patient, mais les investigateurs cliniques ont utilisé son adoption quasi universelle dans divers aspects des études.
Défis
- Logiciels coûteux : Le prix élevé des logiciels de mise en correspondance des essais cliniques freine la croissance du marché. Plusieurs aspects des logiciels, tels que les frais d'initiation, par utilisateur, d'engagement contractuel, par étude, de maintenance, de formation, de support et d'intégration système, augmentent cumulativement le coût global de mise en œuvre des solutions logicielles de mise en correspondance des essais cliniques. De plus, des coûts de personnalisation et de configuration sont facturés aux organisations en fonction de leurs besoins spécifiques en matière d'organisation et de recherche.
- Formation et adaptation insuffisantes : Les professionnels de santé peuvent ne pas avoir la formation essentielle pour utiliser efficacement les outils avancés de mise en correspondance des essais cliniques, ce qui limite leurs bénéfices potentiels. De plus, les essais complexes comportent souvent de multiples variables et des critères d'éligibilité stricts, ce qui complique la fourniture de solutions logicielles permettant une mise en correspondance précise et efficace des patients. Cela crée une lacune dans la conduite globale des essais, ce qui conduit à des résultats incomplets et freine le marché mondial des logiciels de mise en correspondance des essais cliniques.
Taille et prévisions du marché des logiciels de mise en correspondance des essais cliniques :
| Attribut du rapport | Détails |
|---|---|
|
Année de base |
2025 |
|
Période de prévision |
2026-2035 |
|
TCAC |
12,5% |
|
Taille du marché de l'année de base (2025) |
209,55 millions USD |
|
Taille du marché prévue pour l'année (2035) |
680,48 millions USD |
|
Portée régionale |
|
Segmentation du marché des logiciels de mise en correspondance des essais cliniques :
Utilisateur final (sociétés pharmaceutiques et biotechnologiques, organismes de recherche clinique (CRO), fabricants de dispositifs médicaux)
Le segment des sociétés pharmaceutiques et biotechnologiques devrait conquérir plus de 46,5 % du marché des logiciels de mise en correspondance des essais cliniques d'ici 2035. Cette évolution est due au grand nombre d'essais cliniques nécessaires au lancement d'un produit. Par exemple, selon le rapport de la FDA américaine d'avril 2024, le CDER a lancé avec succès un centre d'innovation pour les essais cliniques (C3T1) afin de favoriser les initiatives révolutionnaires et de servir de point central de coordination, de partage des connaissances et de communication avec les parties prenantes internes et externes. Ainsi, ce développement en collaboration avec la FDA contribue grandement à l'essor du marché mondial.
Composants (Logiciels, Services)
Le segment des logiciels devrait influencer considérablement le marché des logiciels de mise en correspondance des essais cliniques au cours de la période de prévision. Cette croissance est attribuée à l'utilisation et à l'adoption accrues des essais de médicaments, à la mise en œuvre de la recherche et développement, et aux généreuses contributions des organisations médicales pour promouvoir et mener des essais de médicaments complexes. Par exemple, comme indiqué dans l'article de février 2025 publié par Drug Discovery Today, la probabilité moyenne d'obtention d'une première approbation s'élève à 14,3 % pour les principales sociétés pharmaceutiques de recherche, avec une fourchette générale comprise entre 8 % et 23 %. Cela garantit ainsi un taux de réussite global du développement clinique compris entre 7 et 25 %.
Notre analyse approfondie du marché mondial des logiciels de mise en correspondance des essais cliniques couvre les segments suivants :
|
Utilisateur final |
|
|
Composants |
|
|
Mode de déploiement |
|

Vishnu Nair
Responsable du développement commercial mondialPersonnalisez ce rapport selon vos besoins — contactez notre consultant pour des informations et des options personnalisées.
Analyse régionale du marché des logiciels de mise en correspondance des essais cliniques :
Analyse du marché nord-américain
D'ici fin 2035, le marché nord-américain des logiciels de mise en correspondance des essais cliniques devrait représenter environ 56,2 % du chiffre d'affaires. Des facteurs tels que l'acceptation des systèmes de mise en correspondance des essais de médicaments par les organisations biotechnologiques et pharmaceutiques, les stratégies gouvernementales et l'adoption de logiciels de mise en correspondance des patients et des essais cliniques stimulent fortement l'expansion du marché dans la région. Par exemple, en septembre 2024, les National Institutes of Health (NIH) ont lancé une série d'initiatives, notamment les études expérimentales de base impliquant des humains (BESH), l'évaluation, le financement et les pratiques des essais cliniques, les formulaires d'information humaine, les modèles de protocoles, ainsi que les formations et les ressources nécessaires à la croissance du marché.
Le marché américain des logiciels de mise en correspondance des essais cliniques a gagné en popularité grâce à la mise en place de directives appropriées par les autorités administratives. Par exemple, dans son rapport de septembre 2022, la FDA américaine a proposé l'article 201(h) de la Loi fédérale sur les aliments, les drogues et les cosmétiques (FD&C Act) afin d'inclure les logiciels destinés à fournir une aide à la décision pour le diagnostic, le traitement, la prévention, la guérison ou l'atténuation de maladies ou d'autres problèmes de santé. De plus, en vertu de l'article 520(o)(1)(E), les systèmes d'imagerie médicale tels que les rayons X, la tomodensitométrie (TDM), l'imagerie par résonance magnétique (IRM) et l'échographie sont adaptés à des fins médicales. Par conséquent, la mise en œuvre de ces lignes directrices garantit un impact positif sur la croissance du marché.
Le marché canadien des logiciels de mise en correspondance des essais cliniques connaît une croissance significative grâce aux investissements gouvernementaux et aux contributions des chercheurs. Selon le rapport de juillet 2023 des Instituts de recherche en santé du Canada, le gouvernement du Canada a investi 250 millions de dollars américains pour soutenir le financement des essais cliniques, une initiative visant à renforcer la Stratégie canadienne en matière de biofabrication et de sciences de la vie. Par ailleurs, des chercheurs de l'Institut ontarien de recherche sur le cancer ont développé en février 2024 PMATCH, un système automatisé permettant de mettre en correspondance les essais cliniques de médecine de précision avec les patients cancéreux éligibles. Grâce à ces développements et à ces financements, le marché bénéficie d'une plus grande visibilité et peut ainsi se développer.
Statistiques du marché Asie-Pacifique
Le marché des logiciels de mise en correspondance des essais cliniques en Asie-Pacifique est celui qui connaît la croissance la plus rapide et devrait connaître une croissance lucrative au cours de la période de prévision grâce au grand nombre de patients disponibles. De plus, diverses organisations souhaitent implanter leurs activités de recherche et développement dans la région afin de soutenir l'expansion du marché. Ceci s'explique par l'augmentation du nombre de projets informatiques dans le secteur de la santé, le développement économique et la modernisation complète des infrastructures de santé, en particulier dans les pays en développement comme l'Inde et la Chine, témoignant de l'essor du marché.
Le marché indien des logiciels de mise en correspondance des essais cliniques devrait connaître une croissance substantielle, car ces essais sont facilement mis en œuvre pour l'évaluation des thérapies destinées aux patients atteints de cancer. Par exemple, selon un article publié par la NLM en février 2024, NexCAR19 est la première thérapie cellulaire CAR-T du pays approuvée par la FDA américaine, sur la base de deux essais cliniques menés auprès de 64 patients atteints de leucémie avancée. Ces essais ont montré une diminution significative de la gravité de leur cancer chez 67 % des patients (réponse objective), et une disparition complète chez environ la moitié d'entre eux (réponse complète). Grâce au développement de thérapies innovantes, le marché devrait donc prospérer en Chine. Le marché chinois des logiciels de mise en correspondance des essais cliniques gagne en visibilité grâce aux innovations et aux progrès réalisés dans l'évaluation des aspects cliniques des patients atteints de maladies rares. Selon l'article de la NLM de février 2024, une étude rétrospective a été menée auprès de 1 053 patients hospitalisés atteints d'un carcinome hépatocellulaire concernant l'évaluation de l'intelligence artificielle dans le système de mise en correspondance des essais cliniques (CTMS). L'étude a révélé une fiabilité inter-évaluateurs acceptable comprise entre 0,65 et 0,88 avec un taux de précision compris entre 92,9 % et 98,0 %. De plus, la sensibilité variait entre 51,9 % et 83,5 %, la spécificité entre 99,0 % et 99,1 %, la valeur prédictive positive entre 75,7 % et 85,1 % et la valeur prédictive négative entre 97,4 % et 98,9 %.
Principaux acteurs du marché des logiciels de mise en correspondance des essais cliniques :
- Advarra
- Présentation de l'entreprise
- Stratégie commerciale
- Offres de produits clés
- Performance financière
- Indicateurs clés de performance
- Analyse des risques
- Développement récent
- Présence régionale
- Analyse SWOT
- Antidote Technologies, Inc.
- Accenture
- IBM Clinical Development
- Application mobile pour les essais cliniques Recherche clinique internationale SSS Aris Global Clario Bsi Business Systems Integration AG Microsoft Corporation Ofni Systems Oracle IQVIA Syneos Health ...
Les entreprises qui dominent le marché des logiciels de mise en correspondance des essais cliniques gagnent rapidement en visibilité grâce à la demande croissante d'analyses de données en temps réel de la part des chercheurs. De plus, les progrès de l'intelligence artificielle (IA) transforment les étapes clés de la conception des essais cliniques en vue d'obtenir des taux de réussite cumulés. Dans ce contexte, en janvier 2024, Accenture a annoncé un investissement stratégique dans QuantHealth, via Accenture Ventures, afin de permettre aux entreprises pharmaceutiques et biotechnologiques de développer rapidement et à moindre coût des traitements pour les patients. Cela témoigne d'une approche optimiste pour une expansion efficace et efficiente du marché.
De plus, grâce à une technologie d'IA exclusive entraînée sur un vaste ensemble de données de 350 millions de patients, à d'importants graphiques basés sur des connaissances biomédicales et à des données d'essais cliniques, la plateforme de simulation de QuantHealth peut prévoir les résultats des essais avec une précision considérable. Cela permet également d'évaluer les variations du protocole et de déterminer la conception idéale de l'essai pour réussir, aidant les équipes de recherche et développement (R&D) à prédire plus précisément et plus rapidement les résultats des essais cliniques et à décider si un essai doit progresser, optimiser les cohortes, si les médicaments peuvent être réutilisés et d'autres facteurs cruciaux. Tous ces facteurs contribuent à l'essor du marché à l'échelle mondiale.
Voici la liste de quelques acteurs clés :
Développements récents
- En janvier 2025, Syneos Health a signé un accord avec ACTIVATO afin d'étendre ses compétences en matière d'essais cliniques à un large éventail de domaines thérapeutiques au Japon. L'objectif est d'accélérer son impact en matière de développement clinique sur ce marché en pleine croissance et en constante évolution.
- En juin 2024, IQVIA a annoncé le lancement de One Home for Sites, la toute dernière plateforme technologique offrant une authentification unique et un tableau de bord unique pour les systèmes et tâches clés nécessaires à l'exécution de tous les essais cliniques menés par un site de recherche clinique.
- En mai 2024, Oracle a progressé dans sa solution mondiale Clinical One Randomization and Trial Supply Management (RTSM) en améliorant la régionalisation, l'accès et l'assistance aux utilisateurs concernant les réglementations nationales, ainsi que la fiabilité et la transparence des essais, du début à la fin.
- Report ID: 7333
- Published Date: Aug 26, 2025
- Report Format: PDF, PPT
- Découvrez un aperçu des principales tendances du marché et des insights
- Passez en revue des tableaux de données d’échantillon et des analyses par segment
- Découvrez la qualité de nos représentations visuelles de données
- Évaluez la structure de notre rapport et notre méthodologie de recherche
- Jetez un coup d’œil à l’analyse du paysage concurrentiel
- Comprenez comment les prévisions régionales sont présentées
- Évaluez la profondeur des profils d’entreprise et du benchmarking
- Visualisez comment des insights exploitables peuvent soutenir votre stratégie
Explorez des données et des analyses réelles
Questions fréquemment posées (FAQ)
Logiciel de mise en correspondance des essais cliniques Portée du rapport de marché
L’échantillon gratuit comprend la taille actuelle et historique du marché, les tendances de croissance, des graphiques et tableaux régionaux, des profils d’entreprises, des prévisions par segment, et plus encore.
Contactez notre expert
Droits d’auteur © 2026 Research Nester. Tous droits réservés.




