Marktausblick für Amifampridin:
Der Markt für Amifampridin hatte 2025 einen Wert von 162 Millionen US-Dollar und wird Prognosen zufolge bis Ende 2035 auf 349,7 Millionen US-Dollar anwachsen, was einem durchschnittlichen jährlichen Wachstum von 8 % im Prognosezeitraum von 2026 bis 2035 entspricht. Im Jahr 2026 wird der Markt für Amifampridin auf 174,9 Millionen US-Dollar geschätzt.

Der globale Markt für Amifampridin befindet sich aufgrund seiner zunehmenden Anwendung in der Therapie des Lambert-Eaton-Myasthenie-Syndroms (LEMS) und der wachsenden Zahl von Orphan-Arzneimittelzulassungen in einem tiefgreifenden Wandel. LEMS lässt sich typischerweise in die Subtypen Autoimmun-LEMS (A-LEMS) und paraneoplastisches LEMS (P-LEMS) unterteilen. Etwa 50 % aller LEMS-Fälle gehen mit einer malignen Grunderkrankung, insbesondere kleinzelligem Lungenkrebs (SCLC), einher. Studien deuten darauf hin, dass LEMS bei etwa 3 % der SCLC-Patienten auftritt und umgekehrt etwa 40–70 % der mit LEMS diagnostizierten Personen im weiteren Verlauf an SCLC erkranken. Obwohl die weltweiten Inzidenz- und Prävalenzraten von LEMS nicht genau bekannt sind, lieferte eine bevölkerungsbasierte Studie, die im August 2025 von Frontiers veröffentlicht wurde, erste Erkenntnisse. In den Niederlanden wurde eine Prävalenz von 2,3 pro Million und eine Inzidenzrate von 0,5 verzeichnet, während in den USA eine Prävalenzrate von 2,6 pro Million gemeldet wurde. Weltweit wird die Prävalenz von LEMS auf 2,8 pro Million geschätzt, womit die Krankheit als seltene Erkrankung eingestuft wird.
Türkei: Epidemiologische Zusammenfassung des LEMS-Patientenpools (2015-2024)
Parameter | Gemeldete Daten |
Bestätigte LEMS-Fälle (2015–2024) | 159 |
Nationale Bevölkerung (2024) | 85.664.944 |
Medianes Alter bei der Diagnose | 60 Jahre (Spanne 16-88) |
Durchschnittsalter ± Standardabweichung | 58,1 ± 14,9 Jahre |
Geschlechterverteilung | Frauen: 55,3 % (n = 88); Männer: 44,7 % (n = 71) |
P-LEMS-Fälle | 59,7 % (n = 95) |
A-LEMS-Fälle | 40,3 % (n = 64) |
SCLC-Assoziation (innerhalb von P-LEMS) | 55,8 % (n = 53) |
Jährliche Inzidenz (2015–2024) | 0,09–0,30 pro Million (0,27/Million im Jahr 2024) |
Gesamtprävalenz (2024) | 1,11 pro Million |
Prävalenz von A-LEMS (2024) | 0,60 pro Million |
P-LEMS-Prävalenz (2024) | 0,51 pro Million |
Mortalität | A-LEMS: 23,4 %; P-LEMS: 58,9 % |
Arzneimittelnutzung (Verschreibung) | Pyridostigmin: 65,4 %; Amifampridin: 24,5 % |
Geografische Verteilung | Höchste Lage im Schwarzen Meer, der Ägäis und Zentralanatoliens |
Quelle: Türkisches Statistisches Institut, Frontiers
Zusammenfassung der klinischen Studie
Klinische Studien haben die Wirksamkeit von 3,4-Diaminopyridin (3,4-DAP) bzw. Amifampridin bei der Förderung der neuromuskulären Übertragung und der Muskelkraft belegt. Mehrere Studien zeigten Verbesserungen in den von Patienten berichteten Werten im Vergleich zu Placebo. Dies führte zu entsprechenden Zulassungen durch zuständige Behörden wie die US-amerikanische FDA und die EMA. Amifampridin hat sich als Goldstandard in der Therapie des Lambert-Eaton-Syndroms (LEMS) etabliert. Aktuelle Studien erforschen optimierte Formulierungen und ein breiteres Anwendungsgebiet im Bereich der neuromuskulären Therapie. Seine Entwicklung stellt einen bedeutenden Meilenstein in der Pharmakotherapie seltener Erkrankungen dar und bietet Patienten mit schwerwiegenden neuromuskulären Übertragungsstörungen eine verbesserte Funktionalität und Lebensqualität.
1. Amifampridinphosphat zur Behandlung kongenitaler myasthenischer Syndrome
Feld | Details |
ClinicalTrials.gov-ID | NCT02562066 |
Zusammenfassung | Randomisierte, doppelblinde, kontrollierte, ambulante Crossover-Studie mit zwei Behandlungsperioden zur Bewertung der Wirksamkeit und Sicherheit von Amifampridinphosphat bei Patienten (Alter ≥2) mit bestimmten genetischen Subtypen von CMS, die unter offener Behandlung (Amifampridinphosphat) oder in der Vergangenheit einen anhaltenden Nutzen gezeigt haben. |
Rekrutierungsstatus | Vollendet |
Bedingungen / Indikation | Myasthenische Syndrome, kongenital |
Intervention(en) | Medikament: Amifampridinphosphat (oral) - Fortsetzungsstudie vs. Placebo (verblindet während der Crossover-Phasen) |
Phase | Phase 3 |
Studientyp | Interventionell |
Altersbereich (berechtigt) | Mindestalter: 2 Jahre; Höchstalter: 70 Jahre |
Teilnehmerzahl / Stichprobengröße | Nicht im Auszug enthalten |
Wichtige Startvoraussetzung | Offene, nicht verblindete Eskalations-/Einlaufphase der Behandlung von bis zu 4 Wochen, bis eine stabile Dosis/Häufigkeit über 7 Tage vor der Randomisierung erreicht ist. |
Primäres Ziel / Endpunkt (implizit) | Bewertung der Wirksamkeit und Sicherheit von Amifampridinphosphat im Vergleich zu Placebo bei CMS. (Der genaue Text des primären Endpunkts ist im Auszug nicht enthalten.) |
Ausschlusskriterien | 1. CMS-Subtypen: Acetylcholinesterasemangel, Slow-Channel-Syndrom, LRP4-Mangel, Plectinmangel. 2. Herzleitungsstörungen im Screening-EKG. 3. Anfallserkrankung. 4. Abnormale Leberfunktionswerte bei der Vorsorgeuntersuchung. 5. Abnormale Nierenfunktionswerte bei der Vorsorgeuntersuchung. 6. Abnorme Elektrolytwerte beim Screening. 7. Schwangerschaft/Stillen oder geplante Schwangerschaft. 8. Jede klinisch relevante, unbehandelte systemische Infektion. 9. Behandlung mit einem anderen Prüfpräparat/Prüfgerät/Biologikum innerhalb von 30 Tagen vor dem Screening. 10. Jede andere Erkrankung, die nach Ansicht des Prüfers zu Beeinträchtigungen oder einem erhöhten Risiko führen könnte. 11. Bekannte Allergie gegen Pyridin-haltige Substanzen oder Studienhilfsstoffe. |
Hauptansprechpartner / Standort | Bostoner Kinderkrankenhaus |
Download-/Aufnahmedatum | 02.04.2021 |
Quelle: Boston Children's Hospital
2. Amifampridinphosphat
Abschnitt | Details |
NOC-Datum | 31. Juli 2020 |
Sponsor | KYE Pharmaceuticals Inc. |
Genehmigungsstatus von Health Canada | NOC |
Überprüfungsverfahren bei Health Canada | Prioritätsprüfung |
Vergleichsgerät | Placebo (Entzugsstudien) |
Therapeutisches Ziel | Verbesserung der gesundheitsbezogenen Lebensqualität (HRQoL) und der funktionellen Aktivitäten des täglichen Lebens (ADL) |
Beurteilungsmethoden (gemäß klinischem Experten von CADTH) | Subjektive Reaktion des Patienten; objektive neurologische Untersuchung; 3TUG (Triple Timed-Up-and-Go) oder QMGS; elektrophysiologische Untersuchung (CMAP-Amplitude vor/nach maximaler willkürlicher Kontraktion). |
Zulassungsstudien eingeschlossen | 1. LMS-002 2. LMS-003 |
Studiendesign | Phase-III-Studien: multizentrisch, randomisiert, doppelblind, placebokontrolliert, mit Ausschlusskriterien |
Hauptzweck | Zur Beurteilung der Sicherheit und Wirksamkeit von Amifampridinphosphat bei erwachsenen Patienten mit LEMS |
Highlights der Teilnahmeberechtigung | Erwachsene Patienten mit bestätigter LEMS; Amifampridin-naiv erforderlich, eine QMGS-Verbesserung von ≥3 Punkten während der Einlaufphase erforderlich; alle Patienten benötigten ≥91 Tage vorherige Amifampridin-Einnahme und ≥7 Tage stabile Dosierung. |
Kontinuierliche Nutzung | Bei Patienten, die auf die Therapie ansprechen, wird eine lebenslange Fortsetzung erwartet. Bei Patienten, die nicht auf die Therapie ansprechen, wird die Therapie aufgrund kombinierter subjektiver und objektiver Kriterien (Ansprechen des Patienten, neurologische Untersuchung, 3TUG/QMGS, Elektrophysiologie) abgebrochen. |
CADTH-Schlussfolgerung (implizit) | Amifampridinphosphat zeigt in Studien zum Absetzen des Lambert-Eaton-Syndroms eine statistisch signifikante Wirksamkeit gegenüber Placebo; Verbesserungen der funktionellen Ergebnisse und vom Patienten berichtete Vorteile belegen die klinische Relevanz; handhabbares Sicherheitsprofil. |
Quelle: NCBI, CADTH (Canadian Agency for Drugs and Technologies in Health) – Klinische Überprüfung, 2024
Schlüssel Amifampridin Markteinblicke Zusammenfassung:
Regionale Highlights:
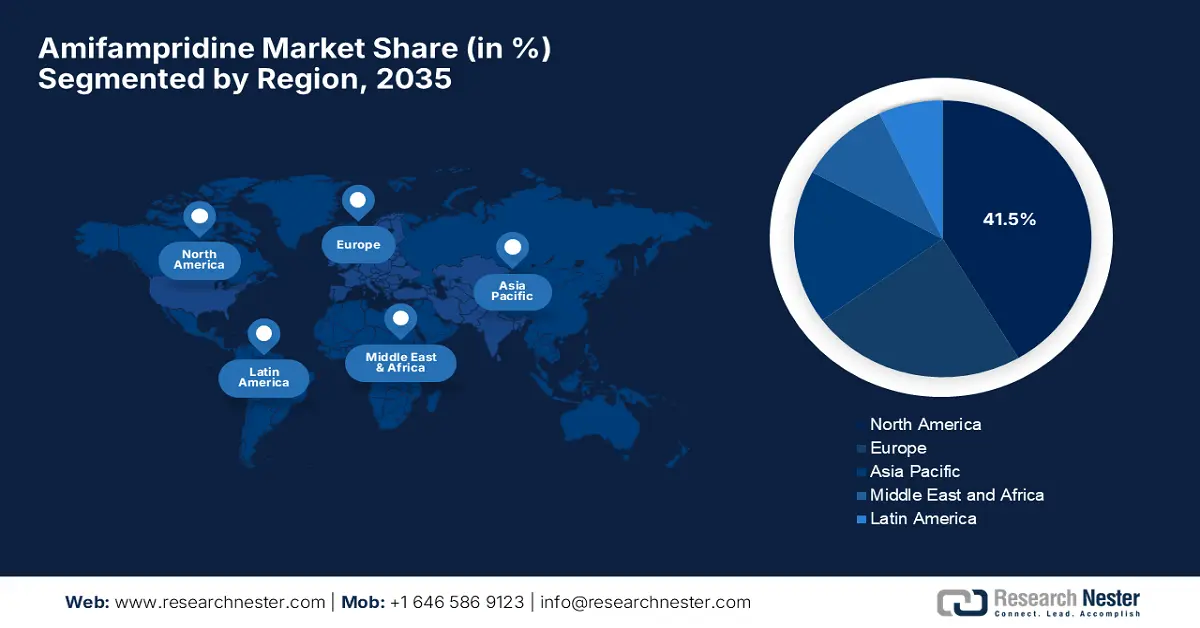
- Es wird geschätzt, dass der nordamerikanische Markt für Amifampridin bis 2035 einen Anteil von rund 41,5 % erreichen wird, was auf eine robuste medizinische Infrastruktur und ein wachsendes Bewusstsein für neuromuskuläre Erkrankungen zurückzuführen ist.
- Der asiatisch-pazifische Markt dürfte im Zeitraum 2026-2035 ein signifikantes Wachstum verzeichnen, bedingt durch die zunehmende Zahl neuromuskulärer Erkrankungen und den verbesserten Zugang zu Behandlungsmethoden.
Segmenteinblicke:
- Es wird erwartet, dass das Generika-Segment bis 2035 den größten Anteil von 75,4 % am Amifampridin-Markt erreichen wird, angetrieben durch die steigende Nachfrage nach erschwinglichen therapeutischen Lösungen.
- Dem Segment Myasthenia gravis wird im Zeitraum 2026-2035 voraussichtlich ein lukrativer Anteil zugeschrieben, da die Prävalenz dieser mit Amifampridin behandelbaren Krankheit zunimmt.
Wichtigste Wachstumstrends:
- Fokus auf die Senkung der Arzneimittelkosten für eine erschwingliche Arzneimittelversorgung
- Steigende Investitionen in Forschungsaktivitäten
Größte Herausforderungen:
- Hohe Behandlungskosten und regulatorische Hürden
Wichtige Akteure: Catalyst Pharmaceuticals (USA), BioMarin Pharmaceutical (USA), Jacobus Pharmaceutical (USA), Medunik Canada (Kanada), ORSPEC Pharma (Australien), Shilpa Medicare (Indien), SERB SA (Frankreich), Tiefenbacher Pharmaceuticals (Deutschland), Chiracon GmbH (Deutschland), Zydus Cadila (Indien), Apotex (Kanada), Sandoz (Schweiz), Teva Pharmaceuticals (Israel).
Global Amifampridin Markt Prognose und regionaler Ausblick:
Marktgröße und Wachstumsprognosen:
- Marktgröße 2025: 162 Millionen USD
- Marktgröße 2026: 174,9 Millionen USD
- Prognostizierte Marktgröße: 349,7 Millionen US-Dollar bis 2035
- Wachstumsprognosen: 8 % jährliches Wachstum (2026–2035)
Wichtigste regionale Dynamiken:
- Größte Region: Nordamerika (41,5 % Anteil bis 2035)
- Region mit dem schnellsten Wachstum: Asien-Pazifik
- Dominierende Länder: Vereinigte Staaten, Deutschland, Frankreich, Japan, China
- Schwellenländer: Indien, Malaysia, Südkorea, Brasilien, Mexiko
Last updated on : 3 November, 2025
Amifampridin-Markt – Wachstumstreiber und Herausforderungen
Wachstumstreiber
- Fokus auf Kostensenkung für erschwingliche Medikamente: Die Preisanalyse des NCBI vom Juli 2022 deutet darauf hin, dass die Behandlung mit Firdapse in Kanada etwa 51.993 USD pro Patient und Jahr kostet. CADTH geht davon aus, dass weitere Kostensenkungen entscheidend sind, um die Marktdurchdringung zu fördern und die Zahlungsbereitschaftsschwelle von 50.000 USD zu erreichen. Laut der klinischen Studie von CADTH aus dem Jahr 2020 lag der angegebene Preis für Amifampridinphosphat bei 21,90 USD pro 10-mg-Tablette und damit 20 % niedriger als der öffentlich verfügbare Preis für Amifampridinbase. Bei einer üblichen Tagesdosis von 61,5 mg belaufen sich die Behandlungskosten für Amifampridinphosphat und Amifampridinbase auf 51.993 USD bzw. 65.051 USD pro Patient und Jahr. Die jährlichen Einsparungen bei Amifampridinphosphat betragen 13.058 USD pro Patient, ohne Berücksichtigung von Abgabegebühren und Aufschlägen.
Zusammenfassung der Ergebnisse der wirtschaftlichen Bewertung des Sponsors (KYE Pharmaceuticals Inc.).
Arzneimittel | Gesamtkosten der Medikamente ($) | Zusätzliche Arzneimittelkosten ($) | Gesamtkosten ($) | Zusätzliche Kosten ($) |
Amifampridinphosphat | 51.993 | Referenz | 55.220 | Referenz |
Amifampridin | 65.051 | –13.058 | 69.062 | –13.841 |
Quelle: Klinische Überprüfung von CADTH
- Steigende Investitionen in Forschung und Entwicklung: Ein weiterer wichtiger Treiber für den Amifampridin-Markt sind die zunehmenden Investitionen in Forschung und Entwicklung. So investierte der forschungsbasierte biopharmazeutische Sektor im Jahr 2020 weltweit rund 198 Milliarden US-Dollar in Forschung und Entwicklung. Laut dem Bericht des Internationalen Verbandes der Pharmazeutischen Hersteller und Verbände (IFPMA) aus dem Jahr 2022 belaufen sich die kombinierten indirekten, direkten und induzierten Effekte des kumulierten Beitrags der Branche zum globalen BIP auf 1.838 Milliarden US-Dollar. Im Vergleich zu allen anderen Hightech-Branchen sind die jährlichen Ausgaben der biopharmazeutischen Industrie etwa 8,1-mal höher als die der Luft- und Raumfahrtindustrie, 7,2-mal höher als die der Chemieindustrie und 1,2-mal höher als die der Software- und IT-Dienstleistungsbranche.
Ausgaben für Forschung und Entwicklung im Bereich Biopharmazeutika
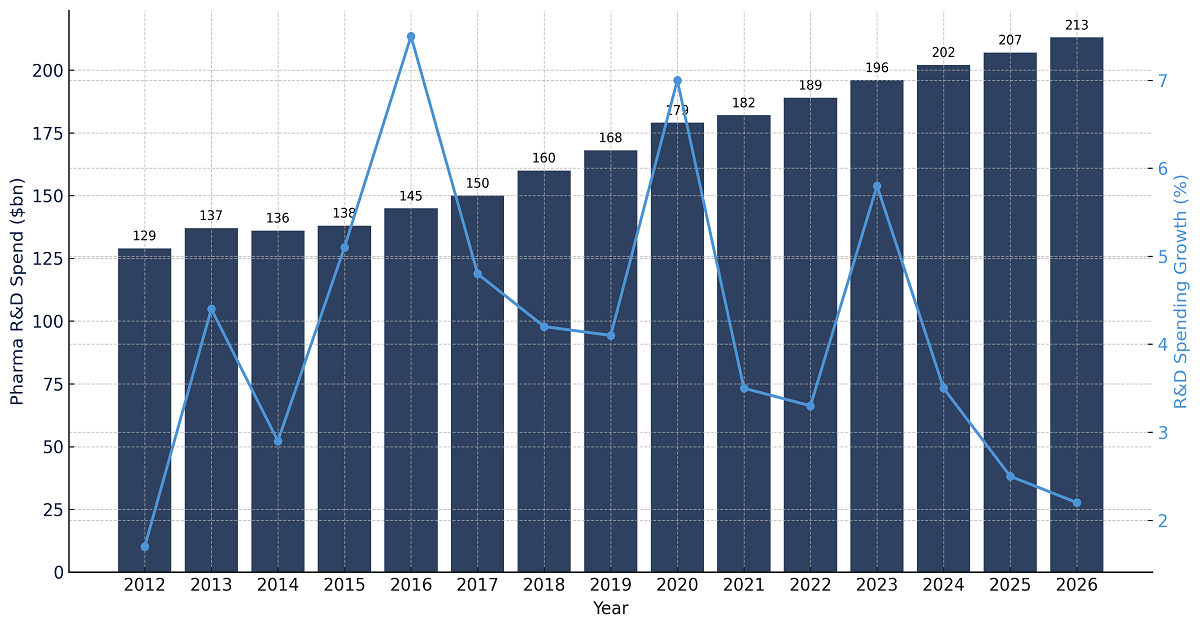
Quelle: IFPMA
Herausforderungen
- Hohe Behandlungskosten und regulatorische Hürden: Dies ist eines der größten Hindernisse für den Markteintritt von Amifampridin in fast allen Ländern. Die hohen Behandlungskosten, die mit den fortschrittlichen Therapieverfahren verbunden sind, sind für Menschen in preissensiblen Regionen unerschwinglich. Budgetbeschränkungen stellen ein erhebliches Hindernis für die Marktdurchdringung in allen Ländern dar. Neben den strengen Vorschriften zur Gewährleistung der Therapiesicherheit können diese Faktoren den Aufbau einer breiten Kundenbasis für Amifampridin erschweren. Die regulatorischen Herausforderungen führen zu einem verzögerten Markteintritt, was insbesondere in wichtigen Regionen wie Japan und Kanada zu beobachten ist.
Marktgröße und Prognose für Amifampridin:
| Berichtsattribut | Einzelheiten |
|---|---|
|
Basisjahr |
2025 |
|
Prognosejahr |
2026–2035 |
|
CAGR |
8% |
|
Marktgröße im Basisjahr (2025) |
162 Millionen US-Dollar |
|
Prognostizierte Marktgröße (2035) |
349,7 Millionen US-Dollar |
|
Regionaler Geltungsbereich |
|
Marktsegmentierung für Amifampridin:
Typensegmentanalyse
Es wird erwartet, dass Generika bis Ende 2035 einen Marktanteil von 75,4 % erreichen werden. Diese Dominanz ist auf die weltweit steigende Nachfrage nach erschwinglichen Therapien zurückzuführen. Generika bilden die Grundlage kosteneffektiver Therapien und machen Behandlungen für einen breiteren Patientenkreis zugänglich – als ideale Alternative zu Markenmedikamenten. Beispielsweise haben die Centers for Medicare & Medicaid Services (CMS) Programme initiiert, um die Verwendung von Generika sowohl für Patienten als auch für Gesundheitsdienstleister zu fördern und so die Gesundheitsausgaben zu senken. Dies treibt das Wachstum des Segments an.
Anwendungssegmentanalyse
Dem Segment Myasthenia gravis wird im Prognosezeitraum ein lukrativer Anteil am Amifampridin-Markt zugeschrieben. Das Wachstum dieses Segments ist auf die steigende Zahl von Myasthenia-gravis-Fällen zurückzuführen, die aufgrund der höheren Wirksamkeit von Amifampridin-Präparaten potenziell behandelt werden können. Darüber hinaus gilt Amifampridin als hochwirksam bei der Verbesserung der Patientenergebnisse durch die Reduzierung von Krankenhausaufenthalten, was zu seiner weltweiten Verbreitung in verschiedenen Märkten geführt hat.
Unsere detaillierte Marktanalyse umfasst die folgenden Segmente:
Segment | Teilsegmente |
Typ |
|
Anwendung |
|
Endbenutzer |
|
Patientendemografie |
|

Vishnu Nair
Leiter - Globale GeschäftsentwicklungPassen Sie diesen Bericht an Ihre Anforderungen an – sprechen Sie mit unserem Berater für individuelle Einblicke und Optionen.
Amifampridin-Markt – Regionale Analyse
Einblicke in den nordamerikanischen Markt
Der nordamerikanische Markt wird bis Ende 2035 voraussichtlich einen Anteil von rund 41,5 % erreichen. Das Wachstum der Region ist auf die robuste medizinische Infrastruktur, das zunehmende Bewusstsein für neuromuskuläre Erkrankungen und die verantwortungsvollen regulatorischen Rahmenbedingungen zurückzuführen. Darüber hinaus profitiert die Region von erheblichen Investitionen öffentlicher und privater Gesundheitsorganisationen in die Behandlung seltener Erkrankungen. Sie beherbergt eine Vielzahl neurologischer Einrichtungen, die eine frühzeitige Diagnose ermöglichen und somit verlässliche Lösungen für Patienten mit ungedecktem medizinischem Bedarf fördern.
Die USA dominieren den nordamerikanischen Markt für Amifampridin, unterstützt durch Investitionen öffentlicher Gesundheitsorganisationen in die Behandlung seltener neuromuskulärer Erkrankungen. So haben beispielsweise die Centers for Medicare & Medicaid Services (CMS) die Gesundheitsausgaben für neuromuskuläre Therapien deutlich erhöht. Darüber hinaus wurde die Kostenübernahme für Therapien seltener Erkrankungen, die Amifampridin enthalten, erweitert, um den Patientenzugang zu verbessern. Auch die National Institutes of Health (NIH) stellten erhebliche Mittel für Forschungsaktivitäten bereit, was die Stärke des Marktes unterstreicht. Die folgende Tabelle zeigt die Ausgaben für die gesamte biopharmazeutische Forschung, einschließlich Amifampridin, im Jahr 2020.
F&E-Ausgaben in den USA, 2020
Funktion | Dollar (Millionen USD) | Aktie (%) |
Prähuman / Präklinisch | 13.604,0 | 14,9 % |
Phase I | 6.968,3 | 7,6 % |
Phase II | 8.429,4 | 9,3 % |
Phase III | 24.773,1 | 27,2 % |
Genehmigung | 3.932,5 | 4,3 % |
Phase IV | 10.512,4 | 11,5 % |
Nicht kategorisiert | 22.906,6 | 25,1 % |
Gesamte Forschung und Entwicklung | 91.126,3 | 100,0 % |
Quelle: IFPMA
In Kanada bietet sich aufgrund der großen Verbraucherbasis und staatlicher Förderprogramme ein enormes Marktpotenzial für Amifampridin. Die Ausgaben für Generika und Biosimilars beliefen sich in Kanada auf 27,4 Milliarden US-Dollar und werden bis Ende 2026 voraussichtlich 32–36 Milliarden US-Dollar erreichen, was einem jährlichen Wachstum von 3–6 % entspricht und die wirtschaftliche Bedeutung der Branche unterstreicht. Darüber hinaus haben die Gesundheitsministerien der Provinzen wie Ontario und British Columbia ihre Investitionen erhöht, was jährlich zu positiven Auswirkungen für Patienten mit LEMS führt. Diese Faktoren dürften den kanadischen Markt weiter ankurbeln und bis 2035 lukrative Wachstumschancen eröffnen.
Einblicke in den APAC-Markt
Der asiatisch-pazifische Markt dürfte im Prognosezeitraum aufgrund der zunehmenden Fälle neuromuskulärer Erkrankungen, des verbesserten Zugangs zu deren Behandlung und erheblicher Investitionen der regionalen Regierungen in das Gesundheitswesen ein signifikantes Wachstum verzeichnen. Darüber hinaus wird das Wachstum in der Region durch die Entwicklungstendenzen von Ländern wie Japan, China, Indien, Malaysia und Südkorea begünstigt. Diese Faktoren prägen die dynamische Marktlandschaft mit dem Ziel, die Behandlungsergebnisse für Patienten zu verbessern und so die Branchenexpansion zu fördern.
Der indische Markt bietet bemerkenswerte Wachstumschancen, angetrieben durch die steigende Nachfrage nach Amifampridin-Medikamenten. So erreichten die Gesundheitsausgaben des Landes im Jahr 2023 2,1 % des BIP, wobei ein erheblicher Teil in das Gesundheitssystem und therapeutische Initiativen floss. In Indien stiegen die Ausgaben für die Behandlung seltener Erkrankungen deutlich an, bedingt durch die bestehende Marktlücke zwischen Angebot und Nachfrage. In Indien gibt es etwa 8.000 seltene Erkrankungen, von denen nur 5 % behandelbar sind. Fast ein Fünftel der Bevölkerung ist betroffen.
Der chinesische Markt für Amifampridin erfährt dank starker Unterstützung der chinesischen Regierung eine immense Aufmerksamkeit. Faktoren wie eine günstige Verwaltungspolitik fördern ein positives Geschäftsumfeld für inländische Unternehmen. Die staatlichen Ausgaben für seltene Erkrankungen in China sind in den letzten fünf Jahren aufgrund des wachsenden Bewusstseins für die Notwendigkeit, diese komplexen Krankheitsbilder zu behandeln, deutlich gestiegen. Darüber hinaus ist China der führende Exporteur von Amifampridin-Derivaten, die hauptsächlich für die Amifampridin-Produktion verwendet werden. Der Exportwert dieser Derivate belief sich laut OEC im Jahr 2023 auf 2,57 Milliarden US-Dollar, der Handelsüberschuss betrug 1,83 Milliarden US-Dollar. Dies unterstreicht Chinas führende Position in der globalen Produktion und im Export dieser Produkte.
Einblicke in den europäischen Markt
Im Prognosezeitraum dürfte der europäische Amifampridin-Markt aufgrund der Entwicklungstendenzen von Ländern wie Deutschland und Frankreich, die den größten Umsatzanteil ausmachen, lukrative Wachstumschancen aufweisen.
Der deutsche Markt profitiert enorm von innovativen Therapiemaßnahmen und Erstattungspolitiken, die das Land als wichtigen Akteur in Europa positionieren sollen. Darüber hinaus trägt die Anwendung fortschrittlicher Behandlungsmethoden und die medizinische Forschung ebenfalls zum Wirtschaftswachstum in der Region bei.
Der französische Markt steht aufgrund seines Engagements für exzellente Gesundheitsversorgung und einen verbesserten Patientenzugang vor einem signifikanten Wachstum. Darüber hinaus erfährt der Markt umfassende staatliche Unterstützung bei der Behandlung seltener Erkrankungen, und die Kostenerstattung ermöglicht eine verstärkte Anwendung des Medikaments. Auch einheimische Pharmaunternehmen tragen zur Weiterentwicklung und Verbesserung der Behandlung mit dem Produkt bei.
Wichtige Akteure auf dem Amifampridin-Markt:
- Catalyst Pharmaceuticals (USA)
- Unternehmensübersicht
- Geschäftsstrategie
- Wichtigste Produktangebote
- Finanzielle Leistung
- Wichtigste Leistungsindikatoren
- Risikoanalyse
- Aktuelle Entwicklung
- Regionale Präsenz
- SWOT-Analyse
- BioMarin Pharmaceutical (USA)
- Jacobus Pharmaceutical (USA)
- Medinik Kanada (Kanada)
- ORSPEC Pharma (Australien)
- Shilpa Medicare (Indien)
- SERB SA (Frankreich)
- Tiefenbacher Pharma (Deutschland)
- Chiracon GmbH (Deutschland)
- Zydus Cadila (Indien)
- Apotex (Kanada)
- Sandoz (Schweiz)
- Teva Pharmaceuticals (Israel)
- Catalyst Pharmaceuticals, Inc. ist ein biopharmazeutisches Unternehmen mit Sitz in Coral Gables, Florida, das sich auf die Entwicklung und Vermarktung von Therapien für seltene Erkrankungen spezialisiert hat. Das Hauptprodukt ist FIRDAPSE, die einzige evidenzbasierte und von der FDA zugelassene Behandlung für erwachsene Patienten mit Lambert-Eaton-Syndrom (LEMS). Die Markteinführung erfolgte im Januar 2019 nach der FDA-Zulassung im November 2018.
- BioMarin Pharmaceutical Inc. ist ein US-amerikanisches Biotechnologieunternehmen mit Hauptsitz in San Rafael, Kalifornien, das sich auf die Behandlung seltener und vernachlässigter Erkrankungen spezialisiert hat. BioMarin entwickelt, erwirbt und vermarktet Therapien für schwere oder seltene Erkrankungen. Die Produktpipeline umfasst Enzymersatztherapien, niedermolekulare Arzneimittel für seltene Erkrankungen und Medikamente gegen neuromuskuläre Erkrankungen. Die Strategie des Unternehmens konzentriert sich auf regulatorische Anreize (Orphan-Drug-Status, Exklusivitätsfristen) und die weltweite Markteinführung von Therapien für seltene Erkrankungen.
- Die Jacobus Pharmaceutical Company, Inc. ist ein US-amerikanisches, privat geführtes Pharmaunternehmen mit Hauptsitz in Princeton/Plainsboro, New Jersey. Es ist spezialisiert auf die Entwicklung und Herstellung von Medikamenten für seltene Erkrankungen, häufig auf Basis von niedermolekularen Wirkstoffen. Jacobus ist bekannt für die Produktion und den Vertrieb von Amifampridin (auch bekannt als 3,4-Diaminopyridin oder 3,4-DAP) unter dem Markennamen Ruzurgi, insbesondere für Kinder und Jugendliche (6–16 Jahre) mit Lambert-Eaton-Myasthenie-Syndrom (LEMS).
- Médunik Canada wurde im Dezember 2009 gegründet und ist eine Tochtergesellschaft der Duchesnay Pharmaceutical Group (DPG). Ziel des Unternehmens ist es, die Gesundheit und Lebensqualität von Kanadiern mit seltenen Erkrankungen zu verbessern, indem es in Partnerschaft mit internationalen Unternehmen Arzneimittel für seltene Krankheiten nach Kanada bringt. Médunik Canada hat seinen Hauptsitz in Kanada (Quebec) und ist Teil des DPG-Netzwerks.
- Orspec Pharma beschreibt sich selbst als spezialisiertes Pharmaunternehmen, das sich auf die Versorgung von Patienten mit seltenen oder spezifischen Erkrankungen mit Medikamenten konzentriert. Das Unternehmen ist im asiatisch-pazifischen Raum tätig und fokussiert sich auf die individuelle Patientenversorgung, die Zulassung von Arzneimitteln für seltene Leiden und Programme für den frühzeitigen Zugang zu Medikamenten. Der Hauptsitz befindet sich offenbar in Australien (West Gosford, NSW), von wo aus die Geschäftstätigkeit die Märkte im asiatisch-pazifischen Raum abdeckt.
Hier ist eine Liste der wichtigsten Akteure auf dem globalen Markt:
Unternehmen im Amifampridin-Markt konzentrieren sich auf verschiedene strategische Aktivitäten, um ihre globale Marktpräsenz zu stärken. Firmen wie Catalyst Pharmaceuticals und BioMarin Pharmaceutical konnten durch die Entwicklung und Vermarktung von Firdapse große Bekanntheit erlangen. Darüber hinaus verbesserten Medunik Canada und Jacobus Pharmaceutical den Patientenzugang zu Ruzurgi, das für Kinder und Jugendliche indiziert ist. Die Unternehmen priorisieren außerdem ihr Produktportfolio, fördern Finanzierungsinitiativen und einen gesunden Wettbewerb.
Neueste Entwicklungen
- Im August 2025 gab Catalyst Pharmaceuticals, Inc. bekannt, dass das Unternehmen und sein Lizenzgeber SERB SA eine Vergleichsvereinbarung mit Lupin Pharmaceuticals, Inc. und Lupin Ltd. unterzeichnet haben, die den von Catalyst und SERB angestrengten Patentstreit beilegt, der als Reaktion auf Lupins Antrag auf Zulassung eines Generikums (Abbreviated New Drug Application, ANDA) zur Erlangung der Zulassung für die Markteinführung einer generischen Version von FIRDAPSE 10 mg Tabletten geführt wurde.
- Im Januar 2025 gab Tiefenbacher Pharmaceuticals die Markteinführung von Amifampridin in Europa bekannt. Es gilt europaweit als Generikum für das Lambert-Eaton-Myasthenie-Syndrom und erlangt damit eine beachtliche Marktpräsenz.
- Report ID: 7694
- Published Date: Nov 03, 2025
- Report Format: PDF, PPT
- Entdecken Sie eine Vorschau auf die wichtigsten Markttrends und Erkenntnisse
- Prüfen Sie Beispiel-Datentabellen und Segmentaufgliederungen
- Erleben Sie die Qualität unserer visuellen Datendarstellungen
- Bewerten Sie unsere Berichtsstruktur und Forschungsmethodik
- Werfen Sie einen Blick auf die Analyse der Wettbewerbslandschaft
- Verstehen Sie, wie regionale Prognosen dargestellt werden
- Beurteilen Sie die Tiefe der Unternehmensprofile und Benchmarking
- Sehen Sie voraus, wie umsetzbare Erkenntnisse Ihre Strategie unterstützen können
Entdecken Sie reale Daten und Analysen
Häufig gestellte Fragen (FAQ)
Amifampridin Umfang des Marktberichts
Die kostenlose Stichprobe umfasst aktuelle und historische Marktgrößen, Wachstumstrends, regionale Diagramme und Tabellen, Unternehmensprofile, segmentweise Prognosen und mehr.
Kontaktieren Sie unseren Experten
Urheberrecht © 2026 Research Nester. Alle Rechte vorbehalten.




